电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为__________________。
(2)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________。
(3)镀铜可防止铁制品腐蚀,电镀时阳极材料为________________,用铜而不用石墨作阳极的原因是______________________。
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是可燃性气体,则其反应的化学方程式为 。该可燃气体在酸性条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe2O3)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
①原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
②氢氧化物的形成: Fe2 + + 2OH-= Fe(OH)2↓ 。
③氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),铁制品表面发生的电极反应式 为 。
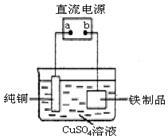
(10分)对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:________________________。
(2)利用右图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为____ ____。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为 NA。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:___________________。
铁及其化合物在生产、生活中有着广泛的应用。
(1)下图是研究海水对铁闸不同部位腐蚀情况的剖面示意图。
在图中A、B、C、D四个部位中,生成铁锈最多的部位________(填字母)。
(2)已知t℃时,反应FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25。则该反应的平衡常数表达式为K=____________;t℃时,反应达到平衡时n(CO):n(CO2) =_______;t℃时,若在1L密闭容器中加入0.02 mol FeO(s)、xmol CO,发生反应,当反应达到平衡时FeO(s)的转化率为50%,则x=________。
Fe(s)+CO2(g)的平衡常数K=0.25。则该反应的平衡常数表达式为K=____________;t℃时,反应达到平衡时n(CO):n(CO2) =_______;t℃时,若在1L密闭容器中加入0.02 mol FeO(s)、xmol CO,发生反应,当反应达到平衡时FeO(s)的转化率为50%,则x=________。
(3)高铁酸钾是一种高效、多功能的水处理剂。工业上常采用NaClO氧化法生产,有关
反应原理为:
3NaClO+2Fe(NO3)3+l0NaOH=2Na2FeO4 ↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH
实验证明,反应的温度、原料的浓度及配比对高铁酸钾的产率都有影响。图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图2为一定温度下,NaClO不同质量浓度对K2FeO4生成率的影响。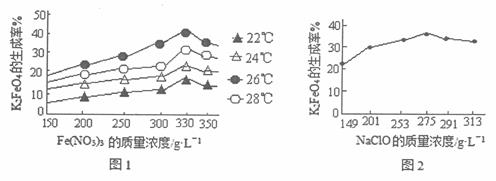
①工业生产中,反应进行的适宜温度为_________℃;此时Fe(NO3)3与NaClO两种溶液的理想的质量浓度之比是____________。
②高铁酸钾做水处理剂时的作用主要有__________________(答出2条即可)。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:____________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母)
(1)反应A+3B 2C+2D在四种不同情况下的反应速率分别如下:
2C+2D在四种不同情况下的反应速率分别如下:
该反应进行的由快到慢顺序为 (填序号)
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如下图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号)_______________。
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的 △H= kJ·mol-1。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色(b),如图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
高炉炼铁过程中发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.653 |
42.875 |
(1)写出该反应的平衡常数表达式:K=____ _____。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= ;平衡时,c(CO)= 。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的体积
F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是 。
| n(Fe2O3) |
0.350 |
0.027 |
0.080 |
0.080 |
| n(CO) |
0.010 |
0.010 |
0.010 |
0.050 |
| n(Fe) |
0.100 |
0.064 |
0.080 |
0.080 |
| n(CO2) |
0.035 |
0.088 |
0.040 |
0.050 |
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________。
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl 2与H2O、NaOH的反应如下: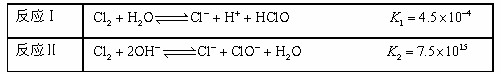
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为: 发生的电极反应式是 。
发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下: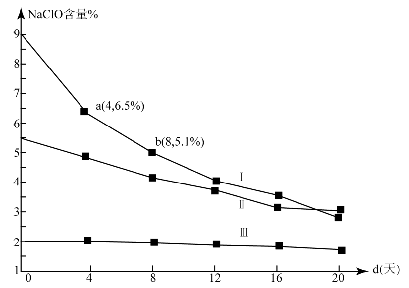
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是 ,原因是 。
②NaClO分解的化学方程式是 。
③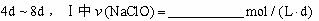 (常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
K, Fe, C, N, O, S是中学化学常见的六种元素。
(1)K位于元素周期表的第 周期第 族;N的基态原子核外有 个未成对电子。基态Fe2+的核外电子排布式是
(2)用“>”或“<”填空:
(3)在250C、l01kPa下,已知CO与NO在一定条件下反应生成N2和CO2,恢复至原状态,平均每转移lmol电子放热153.9kJ,该反应的热化学方程式是
(4)钢铁在有电解质溶液存在的条件下易发生电化学腐蚀。某同学利用钢铁的电化学腐蚀原理,设计如图甲所示实验:
①写出石墨电极的电极反应式:
②将该装置作筒单修改即可成为铁的电化学防护装置,请在图乙中的虚线框内所示位置作出修改。
某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用下图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示 。
(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
已知各离子沉淀时的情况如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
| 完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是 ,
发生反应的离子方程式为 。乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。