北京市朝阳区高三4月第一次综合练习理综化学试卷
下列物质的用途利用了其还原性的是
| A.用葡萄糖制镜或保温瓶胆 | B.用Na2S除去废水中的Hg2+ |
| C.用NaHCO3治疗胃酸过多 | D.用Na2SiO3溶液制备木材防火剂 |
下列解释事实的方程式不正确的是
A.铝热法炼铁: |
B.工业进行“氮的固定”: |
C.铅蓄电池充电时阴极反应: |
D.用铜和稀硝酸制备硝酸铜: |
如图为锌铜显示原电池装置图,下列说法不正确
| A.电子由Zn极流向Cu极 |
B.该装置的总反应 |
| C.一段时间后,A池带正电荷,B池带负电荷 |
| D.取出盐桥,电流计指针不再偏转 |
高分子化合物ASAP和有机试剂H的合成路线如下:
(1)A中含有一个氯原子,生成A的反应类型是 。
(2)B中含有的官能团是 。
(3)D与Ag(NH3)2OH与反应的化学方程式是 。
(4)ASAP是制作尿不湿的材料,其结构简式是 。
(5)N→X的化学方程式是 。
(6)E有多种同分异构体,其中一种在相同条件下也能合成F,该同分异构体结构简式是 。
(7)下列说法正确的是 。
a.1—丙醇的沸点比丙烯的高1
b.有机物M、X均存在顺反异构体
c.相同温度下,A的溶解度比B的小
(8)F的相对分子质量为182,H的结构简式是 。
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl 2与H2O、NaOH的反应如下: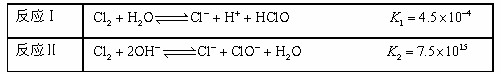
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为: 发生的电极反应式是 。
发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下: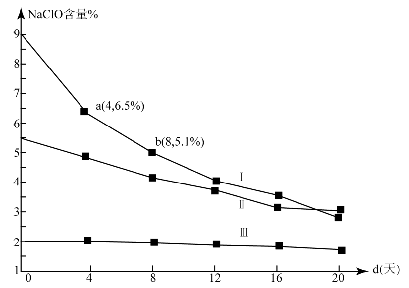
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是 ,原因是 。
②NaClO分解的化学方程式是 。
③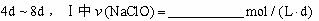 (常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应: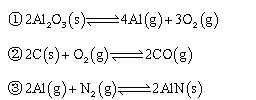
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量:
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: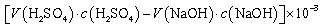
某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 。
(2)调节PH,实验记录如下:
查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号