分别放在0.1mol·L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是
| A.④>③>②>① | B.③>①>②>④ |
| C.④>③>①>② | D.②>③>④>① |
下列关于金属腐蚀的叙述不正确的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.与生铁相比纯铁更容易被腐蚀 |
| C.金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀 |
| D.金属腐蚀的本质是M - ne‑ = Mn+ |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮的表面涂上一层机油 | D.地下钢管连接镁块 |
下列有关金属腐蚀的推断正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况) |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
在三个烧杯中分别盛有海水,依次插入(1)铁片;(2)导线相连的铜、铁片;(3)导线相连的锌、铁片,铁被腐蚀的速度由快到慢的顺序是
| A.(2)(1)(3) | B.(2)(3)(1) |
| C.(1)(2)(3) | D.(3)(2)(1) |
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e—==4OH- |
| D.U型管中溶液pH逐渐减小 |
以下现象与电化学腐蚀有关的是
| A.炒菜的铁锅容易生锈 | B.生铁比纯铁容易生锈。 |
| C.运输石油的管道表面变暗 | D.银质奖牌(纯银制成)久置后表面变暗 |
下列现象与电化学腐蚀无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,接触处容易生铁锈 |
| D.银质奖牌放置久了表面变暗 |
下列叙述中不正确的是
| A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B.溶液中c(H+)>c(OH—),该溶液一定显酸性 |
| C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑ |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+ |
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是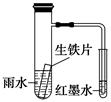
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液pH逐渐减小 |