在原电池和电解池的电极上所发生的反应,属于氧化反应的是( )
| A.原电池的正极和电解池的阳极所发生的反应 |
| B.原电池的正极和电解池的阴极所发生的反应 |
| C.原电池的负极和电解池的阳极所发生的反应 |
| D.原电池的负极和电解池的阴极所发生的反应 |
下列叙述正确的是
| A.用惰性电极电解滴有紫色石蕊试液的饱和食盐水,阴极区附近溶液先变红 |
| B.镀锌的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 |
| C.用惰性电极电解CuSO4溶液,在电解后溶液中加Cu(OH)2固体能使CuSO4溶液恢复到电解前浓度 |
| D.若要在一些金属制品表面镀一层银,则以待镀金属制品作阴极,银作阳极,含有银离子的溶液作电解质溶液网 |
某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是
| A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 |
| D.甲中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )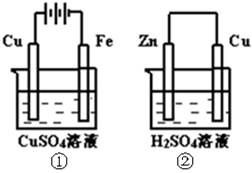
| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑; ②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
将质量相等的Ag片和铂片插入硝酸银溶液(足量)中,银片与电源正极相连,铂片与电源负极相连。以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列为表示银电极的质量、铂电极的质量、电解池中产生气体的质量和电解时间的关系图,正确的是
A. |
B. |
C. |
D. |
如右图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是
| A.AgNO3、KBr | B.CuSO4、NaNO3 |
| C.稀H2SO4、Cu(NO3)2 | D.NaOH、稀H2SO4 |
用铂电极电解CuSO4溶液,当Cu2+浓度降至一半时停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是()
| A.CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4·H2O |
用石墨作电极电解AgNO3溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
| A. AgNO3 | B. H2O | C.Ag2 O | D.Ag(NH3) 2 OH |
用惰性电极电解100mL4mol ·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
| A.2.7 mol· L-1 | B.3 mol· L-1 | C.4 mol· L-1 | D.1 mol· L |
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下左图所示。下列说法中,正确的是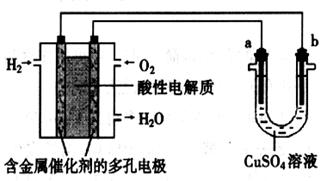
| A.若a极是铜,b极为铁时,当电池消耗1.6g O2,b极上析出6.4g铜 |
| B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。 |
| D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑+ 2H2O |
以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol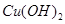 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
在外界提供相同电量的条件下,Cu2+或Ag+分别按Cu2++2e-="Cu" 或Ag++e-=Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为 ( )
| A.12.96g | B.3.24g | C.6.48g | D.1.62g |