如图是一个化学过程的示意图。
已知甲池的总反应式为:2CH3OH+3O2+4KOH
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷(C4H10)为汽油代表,这个电池放电时发生的化学反应 ;
(2)这个电池负极发生的反应是:C4H10 + 13O2— + 26e-=4CO2+5H2O,正极发生的反应是: ;固体电解质里O2-的移动方向是: ;向外电路释放的电子的电极是: ;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是: ;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
下列关于实验现象的描述,正确的是
① 由铜锌组成的原电池,电子是从锌经过导线流向铜
② 把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③ 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④ 把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快
、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)
如图所示,试回答下列问题 (灯泡功率合适):
(1)该装置是 (填“原电池”或“电解池”.)
(2)电解质溶液为稀H2SO4时,灯泡
(填“亮”或“不亮”,填 “亮”做a题,
填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:
Al电极上发生的反应为:
b.若灯泡不亮,其理由为:
(3)电解质溶液为NaOH(aq)时,灯泡
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极为: 极;Al电极为: 极(填“正”“负”)
b.若灯泡不亮,其理由为: .
钒()及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)是接触法制硫酸的催化剂.
①一定条件下,与空气反映t
后,
和
物质的量浓度分别为
和
, 则
起始物质的量浓度为mol/L ;生成
的化学反应速率为
.
②工业制硫酸,尾气用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01 1023个,左槽溶液中
1023个,左槽溶液中的变化量为.
Ⅰ、某同学根据离子方程式:2Fe3++Cu===2Fe2++Cu2+设计了一套原电池装置,从而实现了该反应。在下面画出该原电池的示意简图(正极材料为碳棒,标明正、负极及电极材料和电解质溶液)。
II 、锌锰干电池是应用最普遍的电池之一(如图所示),其基本反应为:
X极:Zn—2e-====Zn2+
Y极:2MnO2+2NH4++2e-====Mn2O3+2NH3+H2O
Y极是电池的_________(填“正”或“负”)极,若反应消耗16.25gZn,则电池中转移电子的物质的是为________________。
利用下列反应:Fe+Cu2+===Fe2++Cu设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解质溶液自选),画出实验装置图,注明电解质溶液的名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)锌片的质量减少了多少?
(2)原稀硫酸溶液的物质的量浓度。
(3)有多少个电子通过了导线。
目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极。在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流。
(1)水煤气成分是 。水煤气又称为合成气,在一定条件下可以合成二甲基醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是 。
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为 。
(3)下图是丙烷、二甲醚燃烧过程中能量变化图,
其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式
若以第⑵问中陶瓷电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有 10.8g银析出,试求制备水煤气时, 至少需要碳 g
已知可逆反应:AsO43-+2I-+2H+ AsO33-+I2+H2O 据此设计出如右图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转
AsO33-+I2+H2O 据此设计出如右图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转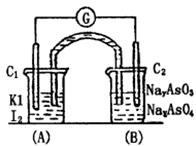
试回答下列问题:
(1)C1棒的电极为 极;发生的电极反应为____________________________.
(2)C2棒的电极为 极;发生的电极反应为____________________________.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。