(11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了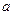 g M,则金属M的相对原子质量
g M,则金属M的相对原子质量
(用含“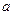 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH

(1)请回答图中甲、乙两池的有关问题:甲池是 装置,B(石墨)电极的名称是 。
(2)写出电极反应式:通入O2的电极的反应式 。A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
(12分)右图是铜锌原电池装置。其电池的总反应是:
Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。
请回答以下问题:
(1)R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液。
(2)电极Y的材料是________,B中的电解质溶液是________________。
(3)X为原电池的______极,其电极反应式是____________________________。
下图为Zn-Cu原电池的示意图,请回答: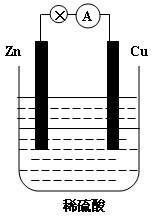
(1)锌片为原电池的 (填“正”或“负”)极,该极的电极反应式是 。该反应属于 (填“氧化”或“还原”)反应。
(2) (填“电子”或“电流”)从锌片通过导线流向铜片,溶液中 的从 (填“锌片”或“铜片”)获得电子。
的从 (填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,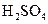 溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为 L(标准状况)。
( 12分)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。
(1)上述图中的三种常用金属的开发利用之所以有先后,主要取决于
(填选项序号)
| A.金属的导电性强弱 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的活动性大小 |
(2)早在西汉成书的《淮南万毕术》里,就有"曾青得铁则化为铜"的记载。曾青又有空青、白青、石胆、胆矶等名称其实都是天然的硫酸铜。
①写出"曾青得铁则化为铜"的离子方程式 。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。
正极反应
负极反应 
③设计一个实验方案,使如图装置中的铁棒上析出铜,而铁的质量不变。(可用文字叙述也可用图示意)。
(3)铁路工人常用铝热反应来焊接钢轨,写出有关的化学方程式 。
教材中引发铝热反应的试剂是 。
如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
(1)酸式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”要释放20m3的甲烷气体,“可燃冰”将成为人类的后续能源。“可燃冰”(用甲烷表示)燃烧的化学反应方程式为: ,若把该反应在一定条件下改装成原电池,则在原电池的负极发生反应的物质是: 。
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为_______ B池为______
(2)锌极为______极,电极反应式为______________
铜极为______极,电极反应式为______________
石墨棒C1为_____极,电极反应式为__________
石墨棒C2为_____极,附近发生的实验现象为_____________
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化(增加或减少)____、_____g,CuSO4溶液的质量变化了(增加或减少了)_____、____g
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ ______;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要属于____________。
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫
酸的物质的量浓度为_________________。
用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是 ,正极的电极反应式是 ,负极的电极反应式是 ,总电极反应式是 。
(9分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如表所示: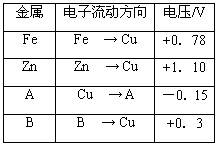
根据实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 。(填“大”、“小”)。
(2)Zn、A、B三种金属活动性由强到弱的顺序是 。
(3)Cu与A组成的原电池, 为负极,
此电极反应式为 。
(4)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
(5)铝热反应中的铝热剂的成分是
工业上常用的铝的冶炼的化学方程式为 。
“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O,则正极反应为 ;该电池工作时,通氢气的一极发生 反应(填氧化、还原),每转移4摩电子,电池内增加 摩水,负极附近溶液的PH值 ,(填升高、降低、不变),正极附近 [H+] (填升高、降低、不变)
为体现绿色世博、低碳世博、科技世博,上海世博会已经开始使用中国自己生产的燃料电池汽车,该车以氢气和空气中的氧气为燃料,KOH为电解质溶液,真正实现了“零排放”。该电池的负极反应式为 ,从能量角度分析氢气用作燃料电池与直接燃烧相比主要优点是 。