2010年全国统一高考理综试卷(重庆卷)化学部分
减缓温室气体排放是2009年哥本哈根气候变化会议的议题。下列反应不产生温室气体的是
| A. | 用纯碱制玻璃 | B. | 用煤炭作燃料 |
| C. | 用铁矿石炼铁 | D. | 用氨制碳酸铵 |
下列实验装置(固定装置略去)和操作正确的是
| A. |
分离
和水 |
| B. |
酸碱中和滴定 |
| C. |
吸收
尾气 |
| D. |
中和热的测定 |
下列叙述正确的是
| A. | 铝制容器可盛装热的 |
| B. | 胶体在电场中自由运动 |
| C. | 与水反应比 与水反应剧烈 |
| D. | 红磷在过量 中燃烧生成 |
当反应达到平衡时,下列措施:①升温②恒压通入惰性气体,③增加的浓度④减压⑤加催化剂⑥恒容通入惰性气体;能提高转化率的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
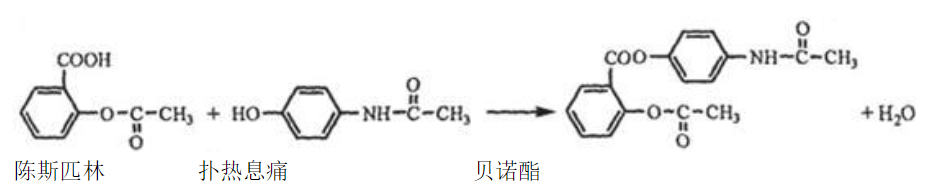
下列叙述错误的是
| A. | 溶液可区别阿司匹林和扑热息痛 |
| B. | 1 阿司匹林最多可消耗2 |
| C. | 常温下贝诺酯在水中的溶解度小于扑热息痛 |
| D. | 是扑热息痛发生类似脂水解反应的产物 |
已知 蒸发1需要吸收的能量为30,其它相关数据如下表:

则表中为
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
=2的两种一元酸和,体积均为100,稀释过程中与溶液体积的关系如图13图所示.分别滴加溶液()至=7,消耗溶液体积为、,则

| A. | 为弱酸, |
| B. | 为强酸, |
| C. | 为弱酸, |
| D. | 为强酸, |
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属和,并含有3.5%(质量分数)。
(1)元素在周期表中位置是
(2)与最活跃的非金属元素形成化合物,的电子式为
(3)配平用钙线氧脱鳞的化学方程式:

(4)将钙线试样溶于稀盐酸,加入过量溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,则检测的方法是
(5)取1.6钙线试样,与水充分反映,生成224(标准状况),在向溶液中通入适量的,最多能得到
某兴趣小组用题图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是反应(填"吸热"或"放热").
(3)为保证在装置4中观察到红棕色气体,装置3应装入;若取消3,在4中仅观察到大量白烟,原因是.
(4)为实现氨催化氧化,也可用装置5替换装置(填装置代号);化合物为(只写一种),的作用是.
阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到和两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备

① 可由人类重要的营养物质水解制得(填"糖类"、"油脂"或"蛋白质").
② 与新制的反应生成,其化学方程式为.
③ 经加聚反应生成,的结构简式为.
(2)阻垢剂的制备

①为取代反应,的结构简式为.
②转化为的过程中,分子中增加的碳原子来源于.
③由制备的反应步骤依次为:
![]() 、、(用化学方程式表示).
、、(用化学方程式表示).
④1的同分异构体(碳链无支链)与足量溶液作用产生2,的结构简式为(只写一种).
钒()及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)是接触法制硫酸的催化剂.
①一定条件下,与空气反映t 后,和物质的量浓度分别为 和 , 则起始物质的量浓度为mol/L ;生成的化学反应速率为 .
②工业制硫酸,尾气用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01 1023个,左槽溶液中的变化量为.
1023个,左槽溶液中的变化量为.




 粤公网安备 44130202000953号
粤公网安备 44130202000953号