将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题: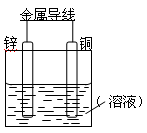
Ⅰ.若电解质溶液为稀硫酸
(1)Zn棒为原电池的 极,其电极反应式为 。
(2)Cu棒为原电池的 极,其电极反应式为 。
Ⅱ.若电解质为硫酸铜溶液,
(3)Cu棒上发生 反应。
(4)若在上述两个过程中,转移电子数相等,则Cu棒上Ⅰ和Ⅱ所析出物质的质量之比为 。
(12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:____________________。该电池总反应式:________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到0.32 g O2,中和电解生成的酸需0.4 mol·L-1 NaOH溶液 mL。
(9分)将反应IO3-+5I-+6H+ 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____________,工作过程中关于电流计的读数,下列说法正确的是_______(填编号)
a.电流计读数逐渐减小 b.电流计读数有可能变为0
c.电流计读数一直不变 d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_____(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为_______,电流计指针向_____(填“左”、“右”)偏转。
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。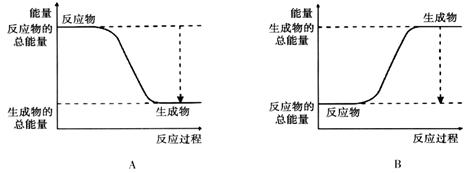
(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 |
H—H |
O=O |
H—O |
| 键能kJ/mol |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量”或“放出热量” |
能量变化kJ |
|
| 拆开化学键 |
2molH2和1molO2中的化学键 |
|
|
| 形成化学键 |
4molH—O键 |
|
|
| 总能量变化 |
|
|
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O。其中,氢气在________极发生________反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
|
③ |
|
|
| 3 |
④ |
|
⑤ |
⑥ |
|
|
⑦ |
|
(1)①和②形成的最简单有机化合物分子的结构式为_____________。
(2)下列事实能证明②的非金属性比⑥强的是
A.Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式___________。
(4)③、④、⑤所形成的简单离子半径由大到小的顺序:___ ____。
(5)①、②、⑦三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
(6)最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示).电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.已知该电池的负极反应为:
C4H10+13O2--26e-===4CO2+5H2O
则该电池的正极反应为__________________,电池工作时,电池中O2-向________极移动.
(10分)(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
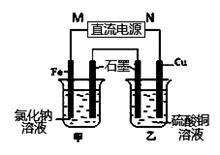
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mole-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。
如下图所示,将铁、铜通过导线相连,置于稀硫酸中。
(1)负极电极反应式 。
(2)正极电极反应式 。
(3)该电池总反应的离子方程式 。
(共13分)由铜、锌和稀硫酸组成的原电池中: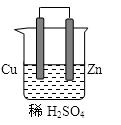
(1)锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)下列装置能够组成原电池是( )
原电池是化学对人类的一个重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是__________,
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:____________________,Cu片上发生的电极反应:____________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻__________。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ __;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式 。
(12分)据图回答下列问题: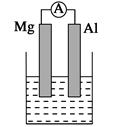
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是___________,负极反应式为:_________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为__ ___。
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。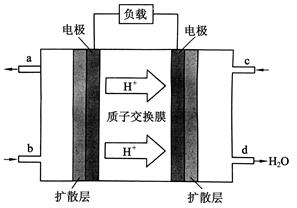
(1)该电池工作时,b通入的物质为_____ __,c通入的物质为___ ___。
(2)该电池负极的电极反应式为:_______
(3)工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有______________NA个电子转移。
(18分)I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。该电池中,负极材料是______,正极反应式为_______。
Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如下图所示。
请回答下列问题:
(1)MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为__________。
(2)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如下图所示。
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式_________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4;溶液的氧化性增强外,还可能是___________。
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如图所示。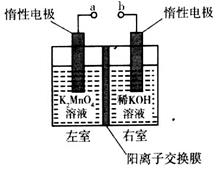
①a应接直流电源的____________(填“正”或“负”)极。
②已知25℃,两室溶液的体积均为100 mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得_______mol KMnO4 (忽略溶液的体积和温度变化)。
下图是某兴趣小组探究不同条件下化学能转变为电能的装置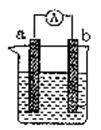
(1)当电极A为Fe、电极B为Cu、电解质溶液为硫酸铜溶液时,正极的电极反应式为
(2)当电极A吸附CH4、电极B吸附O2,电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请写出负极电极反应式