(共4分)(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上 (填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上 (填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。有关的电极反应式:
锌片________________;铜片________________
(10分)CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)= ,则CH3OH的转化率为 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是 。
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-==CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为_____________________。
(12分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是 属于电解池的是_____________。
(2)A池中Zn是_____________极,Cu极发生_____________(填“氧化”或“还原”)反应,电极反应为______ _______。反应过程溶液中c(Cu2+)___________(填“变大”“变小”或“不变”)。
(3)B池中C棒是 极,一段时间后的现象为 ,电极反应为_____ ____。B 池中的总反应为_ __。
(4)C池在化学反应中发生的能量转化形式是 。
X、Y、Z、R、W五种元素分布在三个不同的短周期,它们的原子序数依次增大。YR2是主要的温室气体,W是短周期中金属性最强的元素。甲是W的最高价氧化物的水化物,乙是X、Z组成的最简单化合物。
(1)Z元素在周期表中位于第 周期,第 族。
(2)甲含有的化学键有 。
(3)比较Y、R、W原子半径的大小: < < (填元素符号)。
(4)一定条件下,X单质和R单质在甲的浓溶液中可以形成燃料电池,该燃料电池的正极的反应式是 。
(5)工业上生产乙,若每生成a mol乙时放出b kJ热量,则该反应的热化学方程式为 。
下图为一个原电池,完成下列问题:
(1)负极材料________,正极材料________,电解质溶液是________。
(2)写出电极反应式:负极:__________________________;
正极:___________________________。
(6分)按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: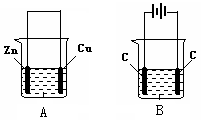
(1)A, B两个装置中,属于原电池的是 (填标号,下同)。
(2)B池中,右边C是 极,电极反应式为: ;
(3)A池中溶解了6.5g锌时,转移了 mol电子。
(8分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。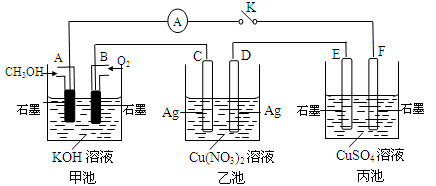
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),
该池的总反应方程式为 。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,加入下列物质能使丙池恢复到反应前浓度的是 (填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
在Zn、Cu、稀硫酸组成的原电池中负极是 .正极反应式: , 电池总反应式:__ ___(离子方程式),电流从_ __极到__ 极,溶液中H+ 移向 _ _极,电池工作一段时间后电解质溶液PH值会变_ _
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+) = 2×10-7 mol/L
①此时溶液中的C(OH-) = ___ __。
②若温度不变,向水中滴入稀盐酸使c (H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) =___ __。
(2)已知下列热化学方程式:Zn(s)+ O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
Hg(l)+ O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的焓变为___ __。
(3)在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
| 加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
| c(OH-)的变化 |
|
减小 |
|
| 平衡移动方向 |
逆向 |
|
逆向 |
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为____ ____。
②锌极为___ ___极,电极反应式为_____ _______;
③当C2极析出224 mL气体(标准状况下),锌的质量减少_ _g
根据所学知识回答下列问题,在如图所示装置中 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为 ,负极反应式为 ,
该装置中的能量变化形式为 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 。
请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
(1)负极材料为: 发生的电极反应是: ,电流 (填“流出”或“流入”)
(2)正极发生的电极反应是: 该反应为 (填“氧化反应”或“还原反应”)
(3)若电路中转移6.02×1022个e-,则产生标况下H2的体积为_ _。
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: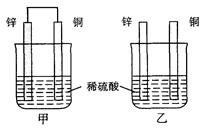
①下列说法正确的是 。
a.甲、乙均为化学能转变为电能的装置
b.乙中铜片上没有明显变化
c.甲中铜片质量减少、乙中锌片质量减少
d.两烧杯中溶液中的H+均减小
②在相同时间内,两烧杯中产生气泡的速度:甲 乙(填“>”、“<“或“=”)
③请写出图中构成原电池的负极电极反应式 。
电池工作时,溶液中SO42-向 极移动电池工作完成后,溶液中SO42-浓度 (填增大或减小或不变)。
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式: 。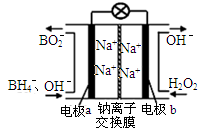
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式: 。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。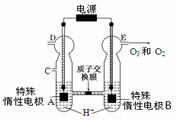
①图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
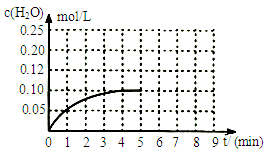
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。