根据所学知识回答下列问题,在如图所示装置中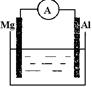 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为 ,负极反应式为 ,
该装置中的能量变化形式为 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 。
根据所学知识回答下列问题,在如图所示装置中 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为 ,负极反应式为 ,
该装置中的能量变化形式为 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 。