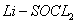 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 。电池的总反应可表示为:
。电池的总反应可表示为:
下列说法错误的是
A.该电池工作时,正极反应为: |
B.锂电极作该电池负极,负极反应为: |
| C.该电池工作时,电子通过外电路从正极流向负极 |
| D.该电池组装时,必须在无水无氧条件下进行 |
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-==Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧 化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是 ( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH- (aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸汽,其中电池的电解质是掺杂了Y2O3(Y为钇)的ZrO2 (Zr为为锆)晶体,它在高温下能传导O2—离子。若以丁烷(C4H10)代表汽油,总反应为2 C4H10+13O2=8CO2+10H2O。有关该电池说法错误的是
| A.该电池负极的电极反应式为:2C4H10+26O2—-52e— = 8CO2+10H2O |
| B.该电池正极的电极反应式为:O2+ 4e—+ 2H2O= 4OH— |
| C.O2—向负极移动 |
| D.丁烷在放电时发生氧化反应 |
已知反应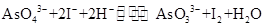 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 、
、 均为石墨电极),分别进行下述操作。
均为石墨电极),分别进行下述操作。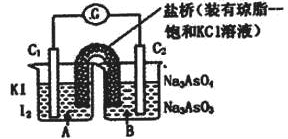
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为:2I――2e-=I2 |
下列说法不正确的是( )
| A.充电电池充电时,发生电解池反应;放电时,发生原电池反应 |
| B.电镀时,应将镀层金属与电源正极相连 |
| C.电解饱和NaCl溶液时,阳极上放出黄绿色气体的同时还产生大量的氢氧化钠 |
| D.利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法 |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。 甲
甲  乙
乙
下列有关叙述正确的的是( )
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+5O2—―8e-=CO32- +2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是 ( )
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
| A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +2H+  +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1- |
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
| A.正极反应为2H2O+O2+4e-===4OH- | B.CO 向负极移动 向负极移动 |
| C.电子由正极经外电路流向负极 | D.电池中CO 的物质的量将逐渐减少 的物质的量将逐渐减少 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42—+ 4H2O |
| C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
| D.放电时正极附近溶液的碱性增强 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
| A.通甲烷的一极为负极,通氧气的一极为正极 |
| B.放电时通入氧气的一极附近溶液的pH升高 |
| C.放电一段时间后,KOH的物质的量不发生变化 |
| D.通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O |