摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH-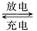 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |
摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH-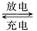 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |