有关下图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是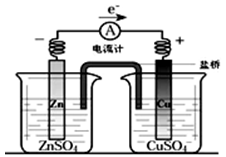
| A.铜是阳极,铜片上有气泡产生。 |
| B.铜离子在铜片表面被还原。 |
| C.电流从锌片经导线流向铜片。 |
| D.反应中,盐桥中的K+会移向ZnSO4溶液。 |
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向 极(填电极的字母序号),f为 (填电极名称)。
(2)a极上的电极反应式是 。
(3)乙池中放出气体的电极为 极(填“c”或“d”),写出此电极反应式: 。
(4)乙池中总反应的离子方程式是 。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。
(1)Cu极为原电池的 极(填“正”或“负”),电极反应式是 ;Zn极发生 (填“氧化”或“还原”)反应。
(2)盐桥中K+移向 (填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针 (填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲 ,乙 。
已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:Ⅰ.向B烧杯中逐滴加入浓盐酸;Ⅱ.向B烧杯中逐滴加入40%NaOH溶液结果发现电流表指针均发生偏转。据此,下列判断正确的是
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:Ⅰ.向B烧杯中逐滴加入浓盐酸;Ⅱ.向B烧杯中逐滴加入40%NaOH溶液结果发现电流表指针均发生偏转。据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为AsO43-+2H++2e-=AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
如下图所示,烧杯中都盛有稀硫酸。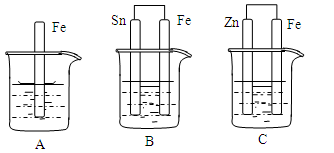
(1)A中反应的离子方程式为 ;
(2)B中的电极反应:Fe: .Sn: Sn极附近溶液的pH(填增大、减小或不变) ;
(3)C中被腐蚀的金属是 。其电极反应式为 。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是 。
如下图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是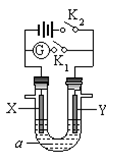
| A.合上K1、断开K2,该装置可以将化学能转变为电能 |
| B.合上K1、断开K2,X是阴极,Y电极附近溶液慢慢变为红色 |
| C.合上K2、断开K1,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝 |
| D.合上K2、断开K1,电解一段时间,X电极附近溶液呈红色 |
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题: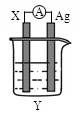
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为_______反应;(填“氧化”或“还原”)
(3)外电路中的电子 (填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。
根据下图所示回答有关问题:
(1)甲池为 (选填“原电池”或“电解池”),石墨A上发生的电极反应式为: 。
(2)乙池中Zn棒为 极, Zn棒上发生反应的电极反应式为: 。
(3)石墨B上刚好有9.6克物质析出时,则反应过程中转移的电子数为 。
电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
(1)工作时电流从 极流向 极(两空均选填“Ag2O”或“Zn”);
(2)负极的电极反应式为: ;
(3)工作时电池正极区的pH (选填“增大”“减小”或“不变”);
(4)外电路中每通过0.2 mol电子,锌的质量理论上减少 g。
圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O。下图为该电池的示意图,下列说法正确的是
| A.a极为电池的正极 |
| B.电池正极的电极反应为:4H+ +O2+4e-=2H2O |
| C.电池工作时电流由a极沿导线经灯泡再到b极 |
| D.电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是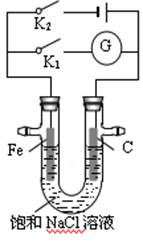
| A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐降低 |
| C.K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002 mol气体 |
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_______________________,发生 反应(填氧化或还原);电子从 经外电路到____ (填锌或铜),溶液中H+ 向 移动(填正极或负极),放电一段时间后,正极区pH值 (填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表,负极电极反应式为_________________,总反应的离子方程式为______ 。
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是
| A.电池工作时,MnO2发生还原反应 |
| B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
| D.电池工作时,K+移向负极 |
可以将氧化还原反应2H2+O2=2H2O设计成原电池。(每空2分)
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_______________;负极的电极反 应式为________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为_______________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。