四川省绵阳市高中高二第二学期期末化学试卷
下列几种化学电池中,不属于可充电电池的是
| A.碱性锌锰电池 | B.手机用锂电池 |
| C.汽车用铅蓄电池 | D.玩具用镍氢电池 |
从化学视角观察和分析,下列说法正确的是
| A.油脂的水解反应又叫皂化反应 |
| B.“低碳”是指采用含碳量低的烃类作为燃料 |
| C.银质物品久置在空气中表面变黑,是电化学腐蚀引起的 |
| D.皮肤、指甲不慎沾上浓硝酸,会发生颜色反应而变黄色 |
下列金属防腐蚀的方法中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源负极 | B.在锅炉内壁装上镁合金 |
| C.汽车底盘喷涂高分子膜 | D.在铁板表面镀锌 |
下列关于H2NCH2COOH和CH3CH2NO2的说法不正确的是
| A.都是有机物 | B.都是共价化合物 |
| C.都是离子化合物 | D.互为同分异构体 |
下列除杂质(括号中为杂质)所选试剂和操作方法均正确的是
| A.苯(苯酚):溴水,过滤 |
| B.乙酸乙酯(乙酸):乙醇及浓硫酸,加热蒸馏 |
| C.乙醇(水):无水氯化钙,分液 |
| D.乙炔(H2S、PH3):硫酸铜溶液,洗气 |
我们使用的塑料食品盒、水杯等通常由聚苯乙烯制成,下列说法正确的是
| A.聚苯乙烯单体的分子式为C8H8 |
| B.聚苯乙烯属于纯净物 |
| C.聚苯乙烯能与溴水发生加成反应 |
| D.聚苯乙烯是可降解塑料,不会造成白色污染 |
苹果酸的结构简式为 ,下列说法错误的是
,下列说法错误的是
| A.苹果酸中能发生酯化反应的官能团有2种 |
| B.苹果酸能发生取代反应、消去反应和缩聚反应 |
| C.1 mol苹果酸最多可与1 mol Na2CO3发生复分解反应 |
| D.与苹果酸官能团种类和个数均相同的同分异构体还有两种 |
洗涤下列试管使用的试剂,不正确的是
| A.沾有苯酚的试管,用碳酸钠溶液洗涤 |
| B.做过银镜反应的试管,用稀氨水洗涤 |
| C.沾有油脂的试管,用氢氧化钠溶液洗涤 |
| D.做过制取酚醛树脂实验的试管,用酒精浸泡后再清洗 |
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该分子的说法正确的是
| A.含有碳碳双键、苯环、羟基、羰基 |
| B.含有碳碳双键、羟基、羰基、羧基 |
| C.1 mol该物质能与5 mol H2发生加成反应 |
| D.与等物质的量的溴单质发生加成反应可得3种产物 |
根据有机物的系统命名法,下列命名正确的是
| A.CH3CH(C2H5)CH2CH2CH32-乙基戊烷 |
| B.CH2=CH(CH3)C=CH22-甲基-1, 3-二丁烯 |
| C.CH2(OH)CH2CH2CH2OH1, 4-二羟基丁醇 |
| D.CH3CH2CHClCCl2CH32, 2, 3-三氯戊烷 |
磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质;电解质中迁移介质是一种有机聚合物,其单体之一M结构简式如下图:
M的结构简式
电池反应为:LiC6+FePO4 LiFePO4+6C
LiFePO4+6C
下列说法正确的是
| A.放电时,体系中的Li+向负极移动 |
| B.放电时,FePO4作正极发生氧化反应 |
| C.充电时,与电源正极相连的电极反应为:LiFePO4-e-==Li++FePO4 |
| D.1 mol有机物M与足量NaOH溶液反应,消耗2 mol NaOH |
分析右下图所示装置,下列叙述不正确的是
| A.左边装置是燃料电池,右边装置是电镀池 |
| B.电子流动方向:b→Zn→CuSO4(aq)→Cu→a |
| C.一段时间后,左端溶液浓度变小,右端溶液浓度不变 |
| D.当锌片的质量变化12.8 g时,a极消耗标准状况下的O2 2.24 L |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.6.0 g甲醛分子中共用电子对数目为0.4NA |
| B.标准状况下,22.4 L辛烷完全燃烧生成CO2分子数为8NA |
| C.14 g乙烯和环丙烷组成的混合气体中,含有的氢原子数目为2NA |
| D.电解精炼铜时,若阴极得到电子0.2NA个,则阳极质量一定减少6.4 g |
下列离子方程式与所述事实相符且书写正确的是
A.用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| B.碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH- |
C.肥皂水能使酚酞试液变红:C17H35COO-+H2O C17H35COOH+OH- C17H35COOH+OH- |
D.已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2: 溶液中通入过量CO2: |
 + 2CO2 + 2H2O —→
+ 2CO2 + 2H2O —→ + 2HCO3-
+ 2HCO3-
下列实验操作正确且能达到预期目的的是
| |
实验目的 |
操 作 |
| A |
比较水和乙醇中羟基氢的活泼性强弱 |
用金属钠分别与水和乙醇反应 |
| B |
配制银氨溶液 |
向洁净试管中加入1 mL 2%稀氨水,边振荡试管边滴加2%硝酸银溶液至沉淀恰好溶解 |
| C |
欲证明CH2=CHCHO中含有碳碳双键 |
滴入KMnO4酸性溶液,看紫红色是否褪去 |
| D |
检验某病人是否患糖尿病 |
取病人尿液加稀H2SO4,再加入新制Cu(OH)2浊液,加热,看是否有红色沉淀生成 |
对下列各组反应所属类型的判断和书写均正确的是
| A.CaC2与水反应制乙炔,乙烯与水反应制乙醇——水解反应 |
| B.由苯制硝基苯,由甲苯制TNT——消化反应 |
| C.油脂的硬化,油脂的氢化——加聚反应 |
| D.乙醇与酸性K2Cr2O7溶液反应,乙醛与新制Cu(OH)2浊液反应——氧化反应 |
下列各组有机物,不论按何种比例混合,只要总质量一定,完全燃烧生成水的总质量就相同的是
| A.甲烷、丙烷 | B.甲苯、甘油 | C.甲酸、乙酸 | D.乙醇、乙二醇 |
250 mL K2SO4和CuSO4的混合溶液中c(SO42-)=0.5 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下)。假定电解后溶液体积仍为250 mL,下列说法不正确的是
| A.电解得到Cu的质量为3.2 g |
| B.上述电解过程中共转移电子0.2 mol |
| C.电解后的溶液中c(H+)=0.2 mol·L-1 |
| D.原混合溶液中c(K+)=0.6 mol·L-1 |
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。
(1)Cu极为原电池的 极(填“正”或“负”),电极反应式是 ;Zn极发生 (填“氧化”或“还原”)反应。
(2)盐桥中K+移向 (填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针 (填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲 ,乙 。
苯甲酸和苯甲酸钠均是食品防腐剂。某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应。
按如下流程分离出苯甲酸:
已知:① 苯甲酸熔点为122 ℃,沸点为249 ℃。
② 不同温度下苯甲酸在水中溶解度:4 ℃—0.18 g,18 ℃—0.27 g,75 ℃—2.2 g;
③
请回答下列问题:
(1)仪器X的名称是 ,冷却水应从 口进入(填“a”或“b”)。
(2)分离苯甲酸的操作中,冰水浴冷却滤液的主要目的是 ,制得的苯甲酸晶体中可能含有的杂质是 ,为进一步提纯,应采用的方法是 。
(3)芳香化合物A与苯甲酸分子式相同,A与NaOH溶液反应生成两种盐,该反应的化学方程式是 。
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向 极(填电极的字母序号),f为 (填电极名称)。
(2)a极上的电极反应式是 。
(3)乙池中放出气体的电极为 极(填“c”或“d”),写出此电极反应式: 。
(4)乙池中总反应的离子方程式是 。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下: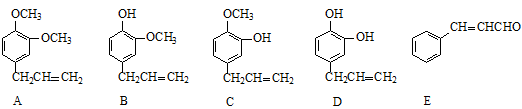
请回答下列问题:
(1)A的分子式为 ;这五种化合物中,互为同分异构体的是 (填序号)。
(2)若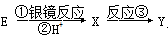 ,且Y是D的同分异构体,写出反应①的化学方程式: ,Y的结构简式为 ,反应③属于 反应。
,且Y是D的同分异构体,写出反应①的化学方程式: ,Y的结构简式为 ,反应③属于 反应。
水解反应是中学化学中的一大类反应。
(1)在 ①酸 ②碱 ③盐 ④不饱和烃 ⑤卤代烃 ⑥醇 ⑦醛 ⑧酯 ⑨低聚糖 ⑩蛋白质等物质中,能发生水解的物质有 (填编号)。蔗糖水解的产物名称为 。
(2)写出二甲基二氯硅烷[(CH3)2SiCl2 ]水解得到二甲基硅二醇的化学方程式: 。
(3)溴乙烷水解实验的操作为:取一支试管,加入0.5 mL溴乙烷,再加入2 mL 5% 的NaOH溶液,充分振荡后静置,待液体分层后,用滴管小心吸取10滴上层水溶液,转入另一盛有10 mL稀HNO3溶液的试管中,然后加入3滴2 % 的AgNO3溶液,观察反应现象。
请根据上述操作回答以下问题:
①本实验中涉及溴乙烷的物理性质主要有 ,稀HNO3的作用是 。
②甲同学在盛溴乙烷和NaOH溶液的试管口塞紧带长玻璃管的单孔橡皮塞,然后水浴加热数分钟,最后液体不再分层。反应的化学方程式为 。
③乙同学认为:要证明上述实验中溴乙烷发生了水解反应,需要先做一个对比实验证明溴乙烷自身不能电离出溴离子,此实验操作步骤和现象是 。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号