某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。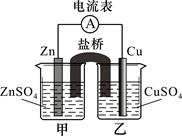
(1)Cu极为原电池的 极(填“正”或“负”),电极反应式是 ;Zn极发生 (填“氧化”或“还原”)反应。
(2)盐桥中K+移向 (填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针 (填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲 ,乙 。
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。
(1)Cu极为原电池的 极(填“正”或“负”),电极反应式是 ;Zn极发生 (填“氧化”或“还原”)反应。
(2)盐桥中K+移向 (填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针 (填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲 ,乙 。