利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
_ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为Ag-e-=Ag+ |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
| D.用KCl溶液代替盐酸,则电池总反应不改变 |
下图是一套电化学装置,对其有关说法错误的是
| A.装置A是原电池,装置B是电解池 |
| B.反应一段时间后,装置B中溶液pH增大 |
| C.a口若消耗1 mol CH4,d口可产生4 mol气体 |
D.a口通入C2H6时的电极反应为C2H6—14e-+18OH-=2 +12H2O +12H2O |
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是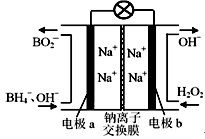
| A.电池工作时Na+从b极区移向a极区 |
| B.b极上的电极反应式为:H2O2+2e-+2H+=2H2O |
| C.每消耗3molH2O2,转移3mole- |
| D.a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
下列叙述中正确的是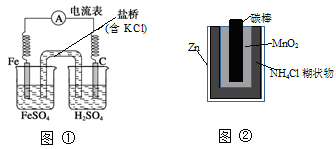
| A.图①中正极附近溶液pH降低 |
| B.图②正极反应是2MnO2(s)+H2O(l)+2e-= Mn2O3(s)+2OH-(aq) |
| C.图①中电子由流向石墨,盐桥中的Cl—移向FeSO4溶液 |
| D.Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是
| A.K+移向催化剂b |
| B.催化剂a表面发生的化学反应:[Fe(CN)6] 4−-e−==[Fe(CN)6] 3− |
C.Fe(CN) 在催化剂b表面被氧化 在催化剂b表面被氧化 |
| D.电解池溶液中的[Fe(CN)6] 4−和[Fe(CN)6] 3−浓度基本保持不变 |
综合下图判断,下列叙述不正确的是
| A.Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu |
| B.Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用 |
| C.随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
| D.取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生 |
用图示的方法可以保护钢质闸门。下列说法正确的是
| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是()
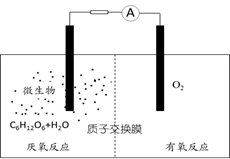
| A. | 正极反应中有 生成 |
| B. | 微生物促进了反应中电子的转移 |
| C. | 质子通过交换膜从负极区移向正极区 |
| D. | 电池总反应为 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

| A. | 铜电极上发生氧化反应 |
| B. |
电池工作一段时间后,甲池的
|
| C. | 电池工作一段时间后,乙池溶液的总质量增加 |
| D. | 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。
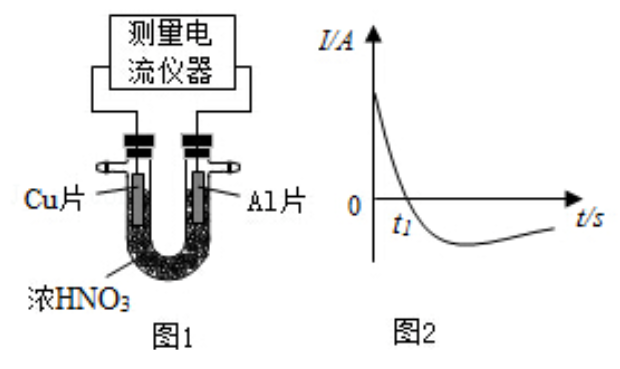
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是
| A.b电极上发生还原反应 |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.a电极上发生的反应为:MnO4-+8H++5e-=Mn2++4H2O |
某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是
| A.甲为原电池,乙、丙均为电解池 |
| B.电子流动方向 :电极Ⅳ→A→电极I |
| C.当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g |
| D.若丙中的电解质改为CuCl2,电极III的电极反应发生改变 |
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是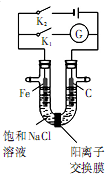
| A.K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B.K1或K2闭合,石墨棒周围溶液pH均升高 |
| C.K2闭合,铁棒上发生的反应为2Cl――2e-=C12↑ |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |