2015年全国统一高考理综试卷(天津卷)化学部分
下列有关"化学与生活"的叙述不正确的是
下列关于物质或离子检验的叙述正确的是()
| A. | 在溶液中加 ,溶液显红色,证明原溶液中有 ,无 |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有 ,无 |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是 |
下列说法不正确的是
| A. | 与 的反应是熵增的放热反应,该反应能自发进行 |
| B. | 饱和 溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 |
| C. | 和 均可加快 分解,同等条件下二者对分解 速率的改变相同 |
| D. |
固体在溶液中存在平衡:
(
)
 (
)+2
(
),该固体可溶于
溶液
(
)+2
(
),该固体可溶于
溶液
|
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

室温下,将0.05固体溶于水配成100溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
501 | 反应结束后, |
| B |
0.05 | 溶液中 增大 |
| C |
50 | 由水电离出的不变 |
| D |
0.1固体 |
反应完全后,溶液减小,不变 |
某温度下,在2的密闭容器中,加入1X(g)和2Y(g)发生反应:,平衡时,、、的体积分数分别为30%、60%、10%。在此平衡体系中加入1Z(g),再次达到平衡后,、、的体积分数不变。下列叙述不正确的是
=2
两次平衡的平衡常数相同
与的平衡转化率之比为1:1
第二次平衡时,的浓度为0.4
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)在元素周期表的位置是
(2)比较、常见离子的半径的小(用化学式表示,下同)
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
(4)已知1e的单质在足量中燃烧,恢复至室温,放出255.5热量,写出该反应的热化学方程式:
(5)上述元素可组成盐:,向盛有101溶液的烧杯中滴加1溶液,沉淀物质的量随溶液体积变化示意图如下:

①离子浓度由大到小的顺序是:
②写出m点反应的离子方程式
③若溶液改加201.2 溶液,充分反应后,溶液中产生沉淀的物质的量为
扁桃酸衍生物是重要的医药中间体,以和为原料合成扁桃酸衍生物F路线如下:

(1)的分子式为,可发生银镜反应,且具有酸性,所含官能团名称为:_,写出的化学反应方程式为.
(2) 中①、②、③3个的酸性有强到弱的顺序是:。
中①、②、③3个的酸性有强到弱的顺序是:。
(3)是由2分子生成的含有3个六元环的化合物,的分子中不同化学环境的氢原子有种。
(4)的反应类型是,1在一定条件下与足量溶液反应,最多消耗的物质的量为:_ .
写出符合下列条件的的所有同分异构体(不考虑立体异构)的结构简式:
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
有多种合成方法,在方框中写出由乙酸合成的路线流程图(其他原料任选)合成路线流程图示例如下:
废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:

回答下列问题:
(1)反应Ⅰ是将转化为,反应中的作用是
(2)反应II是铜氨溶液中的与有机物RH反应,写出该反应的离子方程式:
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加在水中的溶解度
(3)反应Ⅲ是有机溶液中的与稀硫酸反应生成和

(4)操作④以石墨作电极电解溶液。阴极析出铜,阳极产物是
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比高效,且腐蚀性小。请回答下列问题:
(1)净水的原理是。溶液腐蚀钢铁设备,除作用外,另一主要原因是(用离子方程式表示)。
(2)为节约成本,工业上用氧化酸性废液得到。
①若酸性废液中=2.0×10-2·, =1.0×10-3·, =5.3×10-2·,则该溶液的约为。
②完成氧化的离子方程式:++=++
(3)在溶液中分三步水解:
+ +
+
+![]() +
+
+ +
+
以上水解反应的平衡常数、、由大到小的顺序是。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:+
欲使平衡正向移动可采用的方法是(填序号)。
.降温 .加水稀释
.加入NH4Cl .加入
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是。
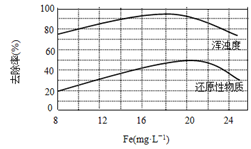
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以·表示]的最佳范围约为·。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号