下列说法不正确的是( )
| A.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW |
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
T℃时,BaSO4在水中的溶解平衡曲线如图所示,下列说法正确的是( )

[已知:Ba SO4 (s) Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
| A.b点无Ba SO4沉淀生成 |
| B.加入BaCl2使溶液由d点变到c点 |
| C.加入Na2SO4使溶液由a点变到b点 |
| D.a点对应的Ksp大于c点对应的Ksp |
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
下列关于沉淀溶解平衡的说法中不正确的是( )
| A.难溶电解质在溶液中存在沉淀溶解平衡,且是一种动态平衡 |
| B.Ksp只与难溶电解质的性质与温度有关,而与沉淀的量和溶液中离子的浓度无关 |
| C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的大小比较电解质在水中溶解能力的大小 |
| D.可通过Q和Ksp的相对大小,来判断沉淀溶解平衡的移动方向 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |
已知25 ℃时,CH3COONH4溶液呈中性。
Ⅰ.将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9。回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因________________________。
(2)混合后溶液中c(CH3COOH)=_________________mol·L-1 (填写精确值)。
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的排列顺序为____________________(填序号)。
Ⅱ. Mg(OH)2沉淀可溶解于NH4Cl溶液。同学对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH-导致沉淀溶解;乙同学认为是NH与Mg(OH)2电离出的OH-反应生成弱电解质NH3·H2O,导致沉淀溶解。
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是( )
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(5)丙同学选择该试剂的理由是:_____________________。
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,由此可知:________(填“甲”或“乙”)的解释更合理。Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:____________________。
(7)现有Mg(OH)2和Al(OH)3沉淀的混合物,若除去Mg(OH)2得到纯净的Al(OH)3,可用______________(填写所用试剂的化学式,试剂从本题涉及的试剂中选取,下同);若除去Al(OH)3得到纯净的Mg(OH)2,可用_________________。
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
下列图示与对应的叙述相符的是
| A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.图2表示0.1 mol·L-1CH3COOH溶液滴定20.00mL0.1 mol·L-1NaOH溶液所得到的滴定曲线 |
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
某学生欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量。其实验过程如图所示:

(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。

(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行 |
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
下列说法错误的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0 |
| B.铅蓄电池放电时的负极和充电时的正极均发生氧化反应 |
| C.氯化镁溶液加热蒸干得不到纯净氯化镁固体 |
D.常温下,向饱和 溶液中加少量 溶液中加少量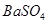 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| |
CaSO4 |
CaCO3 |
MgCO3 |
Mg(OH)2 |
CuS |
BaSO4 |
H2S |
H2CO3[] |
| KSP或Ka |
9.1х10-6 |
2.8х10-9 |
6.8х10-6 |
1.8х10-11 |
6.3х10-36 |
1.1х10-10 |
Ka1=1.3х10-7 Ka2=7.1х10-15 |
Ka1=4.4х10-7 Ka2=4.7х10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+
C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl ="2" MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为____。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为 (填化学式)。[已知Ksp(MnS)=1.4×10-1 5,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3) Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
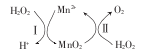
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+( aq)=Mn2+(aq) +O2(g)+2H2O(1) △H2。写出反应I的热化学方程式(焓变用△H1和△H2表示): 。
②某温度时,向10 mL0.4 mol.L-1 H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:

0~2 min时反应速率比2~4 min时的快,其原因是_________;
0~6 min的平均反应速率v(H2O2)= (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:

①反应I的正反应是 (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为 。
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。
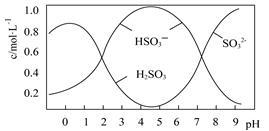
写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)