已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4=Pb(CH3COO)2+(NH4)2SO4。当在醋酸铅溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式正确的是( )
| A.Pb(CH3COO)2+H2S=PbS↓+2CH3COOH |
| B.Pb2++H2S=PbS↓+2H+ |
| C.Pb2++2CH3COO-+H2S=PbS↓+2CH3COOH |
| D.Pb2++2CH3COO-+2H++S2-=PbS↓+2CH3COOH |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+ )>c(C1O-)>c(CH3COO- )>c(OH-)>c(H+) |
| B.碳酸钠溶液中滴加少量氯水的离子方程式:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- |
| C.向0.lmol•L-1CH3COOH 溶液中滴加NaOH 溶液至C(CH3COOH) : C(CH3COO-) =9:5,此时溶液pH = 5 |
| D.向浓度均为1×10 3 mol•L- 的KC1和K2Cr04混合液中滴加1×10 3 mol•L- 的AgN03溶液,CrO42-先形成沉淀 |
根据实验操作和现象所得出的结论正确的是( )
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
将盐酸滴入Na2CO3溶液中 |
有气泡产生 |
氯非金属性比碳强 |
| B |
向2mL 0.1mol/L MgCl2溶液中加入2 mL 1mol/L 的NaOH。观察到白色沉淀后加入2滴FeCl3,静置 |
出现红褐色沉淀 |
同温下 Ksp[Mg(OH )2] >Ksp[Fe(OH)3] |
| C |
向某溶液中滴加KSCN溶液 |
溶液显红色 |
证明原溶液中有Fe3+,无Fe2+ |
| D |
分别将乙烯与二氧化硫通入到酸性高锰酸钾溶液中 |
高锰酸钾溶液均褪色 |
两种气体使酸性高锰酸钾褪色原理相同 |
下列说法不正确的是
| A.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| B.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| C.属于放热和熵增加的反应,就更易自发进行 |
| D.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )

| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
已知25 ℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.O×10一16。下列说法正确的是( )
| A.Ksp(CaF2)随温度和浓度的变化而变化 |
| B.向1 L0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,没有沉淀产生 |
| C.AgCl不溶于水,不能转化为AgI |
D.常温AgCl若在NaI溶液中开始转化为AgI,NaI浓度必须不低于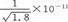 mol·L-1 mol·L-1 |
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示。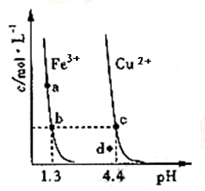
下列判断正确的是
| A.该温度下,Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B.c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等 |
| C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小 |
| D.加适量浓NH3·H2O可使溶液由a点变到b点 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
| A.所得溶液中的[H+]=1.0×10-13mol·L- |
| B.加入Na2CO3固体,可能生成沉淀 |
| C.所加的烧碱溶液pH=13.0 |
| D.所得溶液中的[Mg2+]=5.6×10-10mol·L-1 |
仅根据题中图示得出的结论不合理的是
| |
A |
B |
C |
D |
| 图示 |
 |
 |
 |
 |
| 结论 |
HB为弱酸 |
HF为弱电解质 |
溶解度:AgI<AgCl |
正反应 △H>0 |
自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是
| A.原生铜的硫化物具有还原性 |
| B.常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 |
C.铜蓝的形成过程是: ZnS(S) + Cu2+ CuS(S) + Zn2+ CuS(S) + Zn2+ |
| D.硝酸型酸雨不利于铜蓝的形成: CuS + 2H+ = Cu2+ + H2S↑ |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI> AgCl> Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于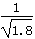 ×10-11mol·L-1 ×10-11mol·L-1 |