25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| D.将水加热,Kw增大,pH不变 |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是

| A.图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
已知t ℃时的Ksp (AgC1) =1.6×10-10,Ksp (AgBr )=7.8×10-13;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是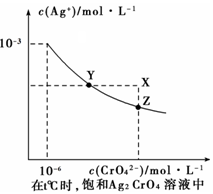
| A.t℃时,Ksp (Ag2CrO4 )=1×10-9 |
| B.t℃时,在饱和Ag2CrO4溶液中加入AgNO3可使溶液由Z点到X点 |
| C.t℃时,溶解度的大小顺序为AgC1 > Ag2CrO4>AgBr |
| D.t℃时,取一定量的KCl和KBr的混和溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,c(C1-)/c(Br-)= Ksp (AgC1)/ Ksp (AgBr) |
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是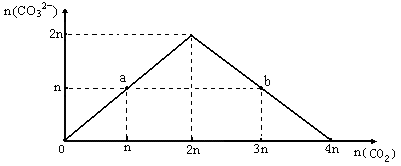
| A.a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 |
| B.a溶液中水的电离程度与b溶液中水的电离程度相同 |
| C.a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) +c(OH-) |
| D.将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
| 实验编号 |
实验操作 |
实验现象 |
| ① |
滴入KSCN溶液 |
溶液变红色 |
| ② |
滴入AgNO3溶液 |
有黄色沉淀生成 |
| ③ |
滴入K3[Fe(CN)6]溶液 |
有蓝色沉淀生成 |
| ④ |
滴入淀粉溶液 |
溶液变蓝色 |
A.①和② B.②和④ C.③和④ D.①和③
向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
| A.白色沉淀 | B.液体分层 | C.无明显现象 | D.黄绿色气体 |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
25℃时,Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,下列说法正确的是( )
| A.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 |
| B.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣) |
C.AgCl和Ag2CrO4共存的悬浊液中,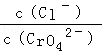 = =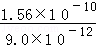 |
| D.向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
下列说法正确的是( )
| A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
已知AgCl的溶解度为1.5×10-4g , AgBr的溶解度为8.4×10-6g ,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀多于AgBr沉淀 | D.AgCl沉淀少于AgBr沉淀 |
Na2FeO4是一种高效的水处理剂,下列用于解释事实的方程式中,不正确的是
| A.Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| B.工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为: 2FeCl3+10NaOH+3NaClO ="==" 2 Na2FeO4+9NaCl+5H2O |
| C.Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为: 4FeO42-+10H2O ="==" 4Fe3++20OH-+3O2↑ |
| D.工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为: |
Fe-6e-+8OH-="==" FeO42-+4H2O
溴酸银(AgBrO3)的溶解度随温度变化曲线如右上图所示,下列说法正确的是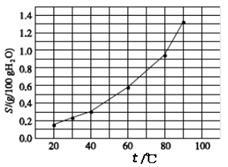
| A.温度升高不利于溴酸银的溶解 |
| B.溴酸银的溶解是放热过程 |
| C.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
| D.60 ℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
25℃,两种酸的电离常数如下表。
| |
Ka1 |
Ka2 |
| H2A |
1.3×10-2 |
6.3×10-6 |
| H2B |
4.2×10-7 |
5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为: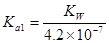
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B