已知各物质的溶度积:Ksp (FeS) =6.3×10-18mol2·L-2 , Ksp (CuS) =1.3×10-36mol2·L-2
下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol•L-1,,K[MgF2]=7.43×10-11.下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
下列有关实验的说法正确的是
| A.用干燥的pH试纸测定新制氯水的pH |
| B.中和滴定实验中,洗净后的锥形瓶不需要干燥 |
| C.用Na2S溶液与AlCl3溶液混合制取Al2S3 |
| D.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(Br-)/c(Cl-)的比值约为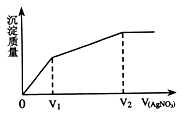
| A.V1/(V2-V1) | B.V1/V2 | C.(V2-V1)/V1 | D.V2/V1 |
化学与生产、生活密切相关,下列叙述错误的是
| A.用热的纯碱溶液清除灶具上的油污 |
| B.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
| C.用硫酸清洗锅炉中的水垢 |
| D.用明矾[KAl(SO4)2·12H2O]作净水剂,除去水中悬浮的杂质 |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp |
1.8×10-10 |
8.51×10-16 |
6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
| A.水的电离程度始终增大 |
| B.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.c(NH4+)/c(NH3•H2O)先增大再减小 |
化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=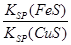
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
| A.②③ | B.①③④ | C.①② | D.②③④ |
含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(
提示:离子沉淀(或沉淀溶解)pH见下表
| 离子 |
Mg2+ |
Al 3+ |
物质 |
Al(OH)3 |
| 开始沉淀pH |
8.93 |
3.56 |
开始溶解pH |
8.04 |
| 完全沉淀pH |
10.92 |
4.89 |
完全溶解pH |
12.04 |

部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25 ℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.HCN + HCOONa = NaCN + HCOOH
下列实验操作正确且能达到目的是
| A.将AlCl3溶液蒸发结晶提取无水AlCl3 |
| B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸除去内壁上的CaSO4 |
| C.在淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2悬浊液并加热,产生红色沉淀 |
| D.将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12。下列关于该温度下的叙述正确的是:
| A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 |
| B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| C.若向0.0008 mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol·L-1) |
| D.若将0.001 mol·L-1 AgNO3溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
| A.Al3+ 、Cl- | B.Al3+ | C.Fe2+、Cl- | D.Fe3+ |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |