已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L 0.2mol·L-1 HF溶液中加入1L 0.2mol·L-1 CaCl2溶液,则下列说法中,正确的是
| A.25℃时,0.lmol·L-1 HF溶液中pH=l |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaC12反应产生沉淀 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是
| A.Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O |
| B.bc段与cd段所消耗CO2的体积相同 |
| C.bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32- |
| D.de段沉淀减少是由于BaCO3固体的消失 |
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10,下列推断正确的是
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
| 离子 |
Mg2+ |
Al3+ |
物质 |
Al(OH)3 |
| 开始沉淀时的pH |
8.93 |
3.56 |
开始溶解时的pH |
8.04 |
| 完全沉淀时的pH |
10.92 |
4.89 |
完全溶解时的pH |
12.04 |

在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
| A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等 |
| B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液 由Y点变为X点 |
| C.T ℃时,Ag2CrO4的Ksp为1×10-8 |
D.图中a=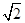 ×10-4 ×10-4 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
| 模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。 下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是( )
| A.Mg(OH)2的溶解度最小 | B.Ca(OH)2的溶解度最小 |
| C.AgCl的溶解度最小 | D.三种物质的Ksp都随着温度升高而增大 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是
| A.AgI比AgCl稳定 | B.碘氧化性比氯弱 |
| C.I-的还原性比Cl-强 | D.溶解度AgI<AgCl |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
溴乙烷与NaOH溶液共热后,加入AgNO3溶液 |
未出现淡黄色沉淀 |
溴乙烷没有水解 |
| C |
向等浓度的KCl、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<Ksp(AgI) |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 |
下层液体显紫红色 |
氧化性:Fe3+>I2 |
下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
已知 ①同温度下的溶解度;Zn(OH)2 > ZnS,MgCO3 > Mg(OH)2;②溶解或电离出S2-的能力:FeS > H2S > CuS,则下列离子方程式错误的是
| A.Mg2++ 2HCO3-+ 2Ca2+ + 4OH-→Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Zn2+ + S2-+ 2H2O→Zn(OH)2↓+ H2S↑ |
| C.Cu2+ + H2S→ CuS↓+ 2H+ |
| D.FeS + 2H+→ Fe2++ H2S↑ |
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是
Ca2++2OH-下列说法正确的是
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
下列叙述正确的是
| A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2 |
| B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4 |
| C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 |
| D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等 |