向含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列说法中正确的是
| A.先生成沉淀,后沉淀全部溶解 |
| B.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
| C.当溶液中SO42-全部沉淀出来时,沉淀的总质量最大 |
| D.当溶液中Al 3+ 全部沉淀出来时,沉淀的总质量最大 |
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
| A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
下列说法不正确的是( )
| A.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW |
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
T℃时,BaSO4在水中的溶解平衡曲线如图所示,下列说法正确的是( )

[已知:Ba SO4 (s) Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
Ba2+(aq)+ SO42—(aq)的平衡常数称为溶度积常数用Ks p表示,Ksp =c(Ba2+)·c(SO42—)]
| A.b点无Ba SO4沉淀生成 |
| B.加入BaCl2使溶液由d点变到c点 |
| C.加入Na2SO4使溶液由a点变到b点 |
| D.a点对应的Ksp大于c点对应的Ksp |
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.②③ | C.③④ | D.②④ |
化学与生产、生活密切相关,下列叙述错误的是
| A.用热的纯碱溶液清除灶具上的油污 |
| B.用硫酸清洗锅炉中的水垢 |
| C.用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质 |
| D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)  Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的
| A.MgCl2 | B.NaOH | C.MgSO4 | D.NaHSO4 |
已知Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgCl> AgBr>AgI |
| C.AgBr >AgCl>AgI | D.AgBr >AgI>AgCl |
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
| A.加MgCl2 | B.加H2O | C.加NaOH | D.加HCl |
下列说法正确的是
| A.可用盐析法分离NaCl溶液和淀粉胶体 |
| B.0.1mol·L-1NaHCO3溶液中:c(Na+ )= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.常温下中和等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 |
| D.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,故新生成的 AgCl可转化为AgI |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |
已知25℃时,AgCl的溶度积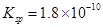 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有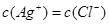 |
C.温度一定时,当溶液中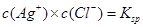 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |