已知25。C时,下表为几种常见物质的溶度积常数;下列有关说法不正确的是( )
| 化学式 |
溶度积常数 |
化学式 |
溶度积常数 |
| Ag2S |
6.3×10-50 |
AgCl |
1.8×10-10 |
| CuS |
4.3×10-36 |
AgBr |
5.4×10-13 |
| FeS |
6.3×10-18 |
AgI |
8.3×10-17 |
A.除去工业废水中的Cu2+可以选用Na2S作沉淀剂
B.将AgCl、AgBr和AgI饱和溶液等体积混合后,再加入足量的浓AgNO3溶液,首先析出AgI沉淀
C.Ag2S、CuS、FeS溶解度依次增大
D.将FeS加入较浓的CuSO4溶液中,会有CuS生成
下列说法正确的是
| A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大 |
| B.0.1mol/L的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀,此时溶液中c(Zn2+)·c(S2-)<Ksp(ZnS) |
| C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小 |
| D.AgCl在10mL 0.01mol/L的KCl溶液中比在20mL0.05mol/L的AgNO3溶液中溶解的质量少 |
下列有关实验现象和解释或结论都正确的选项是( )
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
把SO2通入紫色石蕊试液中 |
紫色褪去 |
SO2具有漂白性 |
| B |
把浓硫酸滴到pH试纸上 |
试纸变红 |
浓硫酸具有酸性 |
| C |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变浅 |
反应2NO2 N2O4的ΔH<0 |
| D |
向AgCl沉淀中滴加KI溶液 |
白色沉淀 变为黄色 |
溶度积:AgI比 AgCl更小 |
已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是 ( )
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。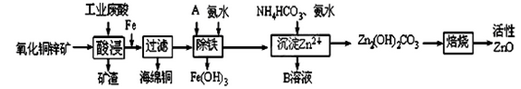
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
下列说法中正确的是 ( )
| A.常温下,某难溶物的Ksp为2.5×105 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.NH3·H2O溶液加水稀释后,溶液中 的值增大 的值增大 |
| D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
已知25℃时, 现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1mol·L-1HF 溶液中pH=1 |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaCl2反应产生沉淀 |
(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
下列说法正确的是( )
| A.向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 |
| B.将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 |
| C.在0.01 mol·L-1 NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 |
D.CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3 Ca2++ CO32- Ca2++ CO32- |
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |