将100mL0.1mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435g沉淀,则下列说法正确的是( )
| A.产生的沉淀是AgCl |
| B.产生的沉淀是AgF |
| C.产生的沉淀是AgCl和AgF |
| D.AgF溶于水 |
下列说法错误的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0 |
| B.铅蓄电池放电时的负极和充电时的正极均发生氧化反应 |
| C.氯化镁溶液加热蒸干得不到纯净氯化镁固体 |
D.常温下,向饱和 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
25℃ CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为( )
| A.9.3×10-5 mol/L | B.9.7×10-9 mol2/L2 |
| C.7.6×10-17 mol4/L4 | D.8.7×10-9 mol2/L2 |
下列叙述不正确的是
| A.CaCO3能够溶解在CO2的水溶液中 |
| B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液 |
| C.AgCl可溶于氨水 |
| D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀 |
下列有关实验操作、现象、解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 |
铜丝变红 |
乙醇和乙醛具有还原性 |
| B |
新生成的AgI浊液中滴入稀KCl溶液,振荡 |
有少量白色沉淀生成 |
AgCl比AgI更难溶 |
| C |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D |
向包有Na2O2粉末的脱脂棉吹气或滴水 |
脱脂棉都会燃烧 |
Na2O2与CO2或水的反应是放热反应 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
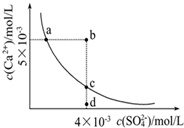
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
向盛有0.1mol/LAgNO3溶液的试管中滴加 0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是
| A.黑色沉淀完全转化为白色沉淀 | B.既有Ag2S也有 AgCl |
| C.不能由黑色沉淀转变为白色沉淀 | D.只有 AgCl白色沉淀 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体, c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后Mg(OH)2不可能转化为MgF2 |
一定温度下,氯化银在水中存在溶解平衡 AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.③>①>②>④ | B.②>①>④>③ |
| C.④>③>②>① | D.①>③>④>② |
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下: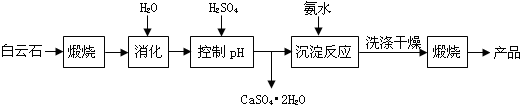
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 _______。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 __(填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质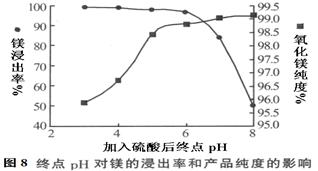
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是 、 。
(4)写出沉淀反应中的离子方程式: 。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 (25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
已知25℃,AgI饱和溶液中,C(Ag+)=1.22×10-8mol/L,AgCl饱和溶液中,C(Ag+)=1.25×10-5mol/L,若在5ml含有KCl和KI各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
| A.C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-) | B.C(K+)>C(NO3-)>C(Ag+)> (Cl-)>(I-) |
| C.C(NO3-)>(K+)> C(Ag+)> (Cl-)>(I-) | D.(K+)> C(NO3-)>C(Ag+)=(Cl-)+(I-) |