饱和石灰水中存在溶解平衡:Ca(OH)2(s)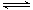 Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 |
| C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4=Pb(CH3COO)2+(NH4)2SO4。当在醋酸铅溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式正确的是( )
| A.Pb(CH3COO)2+H2S=PbS↓+2CH3COOH |
| B.Pb2++H2S=PbS↓+2H+ |
| C.Pb2++2CH3COO-+H2S=PbS↓+2CH3COOH |
| D.Pb2++2CH3COO-+2H++S2-=PbS↓+2CH3COOH |
下列说法不正确的是
| A.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| B.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| C.属于放热和熵增加的反应,就更易自发进行 |
| D.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断: (选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
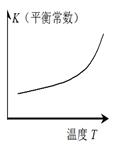
仅根据题中图示得出的结论不合理的是
| |
A |
B |
C |
D |
| 图示 |
 |
 |
 |
 |
| 结论 |
HB为弱酸 |
HF为弱电解质 |
溶解度:AgI<AgCl |
正反应 △H>0 |
自然界各种原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,并向深部渗透时,遇到闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS),下列有关该过程的解释及说法不合理的是
| A.原生铜的硫化物具有还原性 |
| B.常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 |
C.铜蓝的形成过程是: ZnS(S) + Cu2+ CuS(S) + Zn2+ CuS(S) + Zn2+ |
| D.硝酸型酸雨不利于铜蓝的形成: CuS + 2H+ = Cu2+ + H2S↑ |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI> AgCl> Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于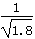 ×10-11mol·L-1 ×10-11mol·L-1 |
在饱和Mg(OH) 2溶液中,c(OH-)=1.0×10-4 mol·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH) 2的溶解度在理论上将( )
| A.变为原来的10-3倍 | B.变为 原来的10-2倍 |
| C.变为原来的103倍 | D.不发生变化 |
CaCO3是一种难溶物质,其Ksp=2.8×10-9 , 先将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为多少?(写出计算过程)
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为( )
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L | C.1.8×10-9mol/L | D.1.8×10-10mol/L |
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
| A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱 |
| B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
| C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比 |
| D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 |
下列实验“操作和现象”与“结论”对应关系均正确的是( )
| |
操作和现象 |
结论 |
| A |
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 |
Ksp:CaCO3<CaSO4 |
| B |
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 |
该电极为阳极 |
| C |
向FeCl3和CuCl2混合溶液中加入少量铁粉,有红色固体析出 |
氧化性:Cu2+<Fe3+ |
| D |
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有Ag+ |