某探究小组用与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
浓度为1.00
·
、2.00
·
,大理石有细颗粒与粗颗粒两种规格,实验温度为298
、308
,每次实验
的用量为25.0
、大理石用量为10.00
。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
大理石规格 |
实验目的 |
||
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究 (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
||||
| ③ |
||||
| ④ |
(2)实验①中质量随时间变化的关系见下图:
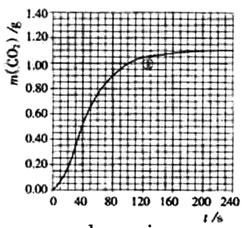
依据反应方程式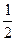
+
=
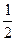
+
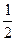
↑+
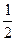
,计算实验①在70-90
范围内
的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中质量随时间变化关系的预期结果示意图。
实验室利用Zn和稀HCl反应制取H2,下列措施中,不能提高化学反应速率的是( )
| A.增大盐酸的浓度 | B.给反应液加热 |
| C.向溶液中加入少量硫酸铜溶液 | D.向溶液中加入醋酸钠晶体 |
某化学反应2A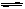 B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度的起始浓度都为零,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
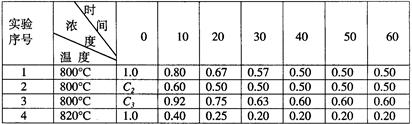
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·L-1·min-1
(2)在实验2,A的初始浓度c2= mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<=),且c3 1.0 mol·L-1(填>、=、<=)。
(4)比较实验4和实验1,可推测该反应是__________反应(选填吸热、放热)。理由是________________。
可逆反应A(气)+B(气) 2C(气)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1molC,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
2C(气)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1molC,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
| A.m>n |
| B.m<n |
| C.m=n |
| D.无法确定 |
已知氯水中有如下平衡:Cl2+H2O HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
(1)针筒中可观察到的现象是________________。
(2)若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是________________。
(3)用化学平衡的观点解释(2)的现象:________________。
某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
(A)均减半 (B)均加倍 (C)均增加1mol (D)均减小1mol
在一容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下: A、 B和C均为4.0mol, D为 6.5mol, F为2.0mol,设E为xmol,x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。
①若x=4.5,则右侧反应在起始时向______方向进行,欲使起始反应维持向该方向进行,则x的取值范围为____ 。
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由图分析不能得出的结论是( )

| A.a是反应物 |
| B.正反应是一个体积扩大的反应 |
| C.若升高温度,a的转化率增大 |
| D.若增大压强,a的转化率减小 |
NO和CO都是汽车尾气中的有害物质,它们能缓慢的起反应,生成N2和CO2,对此反应的下列叙述中正确的是( )
| A.使用催化剂不能加快反应速率 | B.降低压强能加强反应速率 |
| C.升高温度能加快反应速率 | D.改变压强对化学反应速率无影响 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
| A.对该反应体系加热 |
| B.不用稀硫酸,改用98%的浓硫酸 |
| C.滴加少量CuSO4溶液 |
| D.不用铁片,改用铁粉 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速度可由图表示,在下列因素中,①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度,影响反应速度的因素是
| A.①④ |
| B.③④ |
| C.①②③ |
| D.②③ |
已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入1mol N2、3mol H2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物的物质的量分数相同,下列措施中可行的是
| A.向甲容器中充入一定量的氦气 |
| B.向乙容器中充入一定量的NH3气体 |
| C.升高乙容器的温度 |
| D.增大甲容器的压强 |
下图表示外界条件(温度、压强)的变化对下列反应的影响:L(s)+G(g) 2R(g);ΔH>0,则图中Y轴是指( )
2R(g);ΔH>0,则图中Y轴是指( )

| A.平衡混合气中R的质量分数 |
| B.平衡混合气中G的质量分数 |
| C.G的转化率 |
| D.L的转化率 |