一定量的Fe与足量的0.5mol∕l盐酸反应,为了加快反应速率,但又不影响产生氢气的总量,应加入下列物质中的
A.NaNO3溶液 B.将Fe改为用同质量的Na
C.改为用同浓度的硫酸 D.CuSO4粉末
对于工业合成氨反应: N2 + 3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.升高温度可以增大反应速率 |
| C.增大N2浓度可以使H2转化率达到100℅ |
| D.增大N2浓度可以增大反应速率 |
足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的
| A.NaNO3溶液 | B.NaCl固体 | C.Na2SO4溶液 | D.CuSO4粉末 |
下列变化能加快反应速率,且反应物活化分子百分数增加的是
① 升高温度 ②使用证催化剂 ③增大压强 ④增加浓度
A ②④  B ③④ C ①② D ②③
B ③④ C ①② D ②③
用锌片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.用粗锌代替纯锌 | D.不用锌片,改用锌粉 |
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
①该反应的△H 0。
(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应
N2(g)+O2(g) 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
100mL浓度为2 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol/L的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量的蒸馏水 | D.加入适量的氯化钠溶液 |
盐酸倒在碳酸钙粉末上,能使反应的最初速率加快的是
| A.增加碳酸钙的用量 | B.盐酸浓度不变,使用量增加一倍 |
| C.盐酸浓度增加一倍,使用量减半 | D.盐酸浓度不变,使用量减半 |
对于反应A+B=C,下列条件的改变一定使化学反应加快的是
| A.增加A的物质的量 | B.升高体系的温度 |
| C.减少C的物质的量 | D.增加体系的压强 |
生产中常要控制化学反应条件增大反应速率。下列措施中不能加快化学反应速率的是
| A.尽可能使用稀溶液 | B.选择合适的催化剂 |
| C.碾细固体反应物 | D.提高反应体系的温度 |
下列叙述正确的是
| A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷 |
B.对于可逆反应N2(g)+3H2(g)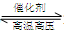 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 |
| C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同 |
下列四种盐酸溶液,均能跟锌片(锌片大小几乎相同)反应,其中最初反应速率最快的是
| A.10℃ 20mL 3mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的盐酸溶液 |
| C.20℃ 20mL 2mol/L的盐酸溶液 | D.20℃ 10mL 4mol/L的盐酸溶液 |
下列条件中不可以加快2H2O2(aq)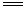 2H2O(l)+O2(g)的化学反应速率的是
2H2O(l)+O2(g)的化学反应速率的是
| A.增大H2O2的浓度 | B.加入MnO2作催化剂 |
| C.升高反应温度 | D.增大压强 |