安徽省亳州市高二上学期期末考试化学试卷
“低碳经济,节能减排”是2010年上海世博会的主题,下列做法符合这一思想的是
A.加大开发水能、风能、核能、太阳能、生物能等新能源
B.研究将二氧化碳深埋海底的技术,以减少大气中二氧化碳的含量
C.大力以满足经济发展的需要
D .减少我国的煤炭开采,加大从澳大利亚等国进口煤炭
.减少我国的煤炭开采,加大从澳大利亚等国进口煤炭
下列条件中可以促进水的电离的是
| A.升高温度 | B.加入少量固体氢氧化钾 |
| C.加入少量固体氯化钠 | D.滴加少量浓盐酸 |
蒸干并灼烧下列物质的水溶液,仍能得到该物质的是
| A.氯化铝 | B.碳酸氢钠 | C.硫酸钠 | D.高锰酸钾 |
钢铁在潮湿的环境中会形成原电池而被腐蚀,下列说法正确的是
| A.原电池的负极反应为:Fe-3e-→ Fe3+ |
B.发生吸氧腐蚀的总反应为:Fe +2H+ Fe2+ + H2↑ Fe2+ + H2↑ |
| C.钢铁设备上连接铜块可以防止腐蚀 |
| D.在南方沿海地区,钢铁更容易被腐蚀 |
下列条件中不可以加快2H2O2(aq)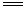 2H2O(l)+O2(g)的化学反应速率的是
2H2O(l)+O2(g)的化学反应速率的是
| A.增大H2O2的浓度 | B.加入MnO2作催化剂 |
| C.升高反应温度 | D.增大压强 |
在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是
| A.Na+、Cu2+、Cl-、SO42― | B.Ba2+、K+、OH-、NO3― |
| C.K+、Ca2+ 、NH4+、CO32― | D.H+、Ca2+、Cl-、HCO3― |
已知反应2CO(g)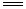 2C(s) + O2(g)的ΔH >0,ΔS<0,设ΔH和ΔS不随温度而变化,下列说法中正确的是
2C(s) + O2(g)的ΔH >0,ΔS<0,设ΔH和ΔS不随温度而变化,下列说法中正确的是
| A.低温下能自发进行 |
| B.高温下能自发进行 |
| C.任何温度下都能自发进行 |
| D.任何温度下都不能自发进行 |
常见的铅蓄电池的电极材料为PbO2和Pb,电解液为30%的稀硫酸溶液,电池放电的总反应为:PbO2 + Pb + 2H2SO4  2PbSO4 + 2H2O,则下列说法正确的是
2PbSO4 + 2H2O,则下列说法正确的是
| A.PbO2为电池的负极 | B.放电时电子由正极流向负极 |
| C.放电时正极发生氧化反应 | D.放电时电解液的pH值逐渐增大 |
常温下,将pH=13的NaOH溶液与pH=2的HCl溶液按1∶9的体积比混合,设混合溶液的总体积为二者相加,则所得混合液的pH值是
| A.11 | B.15 | C.12 | D.7.5 |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.常温常压下,11.2 L氯气与足量钠充分反应转移电子数为NA |
| B.常温常压下,17g氨气中含氢原子数为3NA |
| C.标准状况下电解水,阴极生成11.2L气体,则电路中通过的电子数为2NA |
| D.1L 1mol·L-1的Na2CO3溶液中含有NA个CO |
下列离子方程式中正确的是( )
A.鸡蛋壳在醋酸中溶解:CO32-+ 2CH3COOH 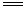 2CH3COO- + CO2↑+ H2O 2CH3COO- + CO2↑+ H2O |
B.Na2CO3溶液使酚酞变红:CO32-+H2O  HCO3- + OH- HCO3- + OH- |
C.向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2+ + SO42-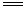 BaSO4↓ BaSO4↓ |
D.向NaHCO3溶液中加入稀盐酸溶液:CO32-+2H+ H2O + CO2↑ H2O + CO2↑ |
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是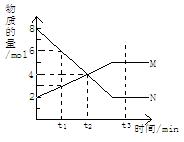
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
一定温度下,在容积不变的密闭容器中发生反应:2NO2(g) 2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③容器内气体的压强不再改变 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变
| A.①②④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
(1)已知天然气和水蒸气反应的热化学方程式为:CH4(g) + H2O(g)  CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
CO(g)+ 3H2(g) ΔH =+206.4kJ·mol-1,则制得56g CO需要吸收的热量为 kJ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH = kJ·mol-1。
CO2(g)+H2(g) ΔH =-41.0kJ·mol-1 ,若将1mol CH4与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH = kJ·mol-1。
下图表示一个电解 池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则: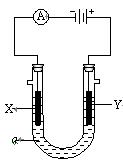
(1)X电极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y电极上的电极反应式为 ,
若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为 g 。
用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空:
(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;
(2)滴定:用0.2000 mol·L-1标准盐酸溶液滴定待测溶液,下面的操作错误的有  。
。
①用标准盐酸溶液润洗酸式滴定管;
②用待测烧碱溶液润洗锥形瓶;
③两个同学合作,一人控制酸式滴定管的活塞,另一人摇动锥形瓶;
④滴定过程中,操作者的眼睛始终注视酸式滴定管液面的变化。
(3)根据下表数据计算:
①待测烧碱溶液的物质的量浓度:  (结果保留4位有效数字);
(结果保留4位有效数字);
②烧碱的纯度: 。
| 滴定次数 |
待测溶液 体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读 数(mL) 数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.45 |
| 第二次 |
10.00 |
4.00 |
24.05 |
在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4)(mol) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2)(mol) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平 衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
Br2和Fe3+ 的水溶液浓度较小时均呈现黄色,二者都具有较强的氧化性。某化学兴趣小组拟通过探究实验来比较二者氧化性的强弱。
实验操作:向足量的硫酸亚铁溶液中加入少量浓溴水,振荡。
实验现象:溶液由浅绿色变为黄色。
(1)提出假设:
甲同学认为氧化性:Br2 >Fe3+ ,则反应的离子方程式为 ;
乙同学认为氧化性:Fe3+ >Br2 ,则使溶液呈黄色的物质是 (填化学式)。
(2)通过进一步实验可以检验甲和乙的结论谁对谁错,下列是设计的一些实验方案和预测:
| 方案 |
实验操作 |
预期现象及结论 |
| 1 |
取少量黄色溶液,加入NaOH溶液 |
若生成红褐色沉淀,则甲正确 |
| 2 |
取少量黄色溶液,加入淀粉KI溶液 |
若溶液变蓝色,则乙正确 |
| 3 |
取少量黄色溶液,加入苯溶液,振荡后静置 |
若上层溶液呈橙红色,则 正确 |
①方案1是否合理 (填“是”或“否”)。
②方案2中,由于存在反应 (用离子方程式表示),
(用离子方程式表示),
所以预测结论不正确。
③请另外设计一个合理方案,证明已经发生反应。将有关内容填入下表。
| 实验操作 |
预期现象及结论 |
| |
|
 粤公网安备 44130202000953号
粤公网安备 44130202000953号