已知氯水中有如下平衡:Cl2+H2O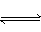 HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。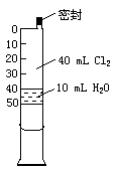
(1)针筒中可观察到的现象是________________。
(2)若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是________________。
(3)用化学平衡的观点解释(2)的现象:________________。
已知氯水中有如下平衡:Cl2+H2O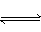 HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
HCl+HClO。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸人40mLCl2和10mL H2O。
(1)针筒中可观察到的现象是________________。
(2)若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是________________。
(3)用化学平衡的观点解释(2)的现象:________________。