2008年全国统一高考化学试卷(广东卷)
2007年诺贝尔化学奖得主Gerhard Ertl对金属表面催化氧化反应的模型进行了深入研究。下列关于 的说法正确的是
的说法正确的是
 和
和
 的质子数相同,互称为同位素
的质子数相同,互称为同位素
 和
和
 的中子数相同,互称为同位素
的中子数相同,互称为同位素
 和
和
 的核外电子数相同,是同一种核素
的核外电子数相同,是同一种核素
 和
和
 的质量数不同,不能互称为同位素
的质量数不同,不能互称为同位素
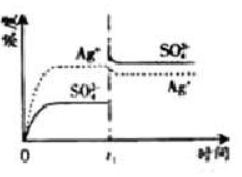
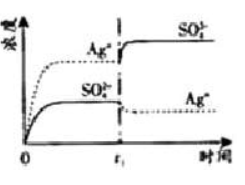
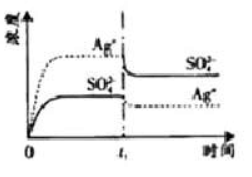
已知
的
为2.0×10 -3,将适量
固体溶于100
水中至刚好饱和,该过程中
和
浓度随时间变化关系如下图(饱和
溶液中
=0.034
)。若
时刻在上述体系中加入100
. 0.020
溶液,下列示意图中,能正确表示
时刻后
和
浓度随时间变化关系的是( )
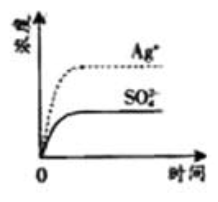
| A. |
|
B. |
|
| C. |
|
D. |
|
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A. | 在 溶液中加入与其等物质的量的 ,溶液中的阴离子只有 和 |
| B. | 溶液中: |
| C. | 10 0.10 溶液加入等物质的量的 后,溶液中离子的浓度由大到小的顺序是: |
| D. | 中和体积与 都相同的 溶液和 溶液所消耗的 物质的量相同 |
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是溶液分别滴定溶液和溶液的滴定曲线示意图。下列示意图中,能正确表示用·溶液滴定和混合溶液的滴定曲线的是()

| A. |
|
| B. |
|
| C. |
|
| D. |
|
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是()
| A. | ①②③④ | B. | ①②⑤⑥ |
| C. | ③⑤⑥⑦ | D. | ①③④⑦ |
将和充入恒容密闭容器,恒温下发生反应平衡时的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时的转化率为b。a与b的关系是()
| A. | a>b | B. | a="b" | C. | a<b | D. | 无法确定 |
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g) WI2(g) (温度)。下列说法正确的是()
WI2(g) (温度)。下列说法正确的是()
| A. | 灯管工作时,扩散到灯丝附近高温区的 会分解出 重新沉积到灯丝上 |
| B. | 灯丝附近温度越高, 的转化率越低 |
| C. | 该反应的平衡常数表达式是 |
| D. | 利用该反应原理可以提纯钨 |
下列有关能量转换的说法正确的是( )
| A. | 煤燃烧是化学能转化为热能的过程 |
| B. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C. | 动物体内葡萄糖被氧化成 是热能转变成化学能的过程 |
| D. | 植物通过光合作用将 转化为葡萄糖是太阳能转变成热能的过程 |
下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量 : |
| B. | 少量 通入 溶液中: |
| C. | 用稀 溶液 固体: |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合: |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是()
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 |
| C. | 从海水中可以得到 ,电解熔融 可制备 |
| D. | 利用潮汐发电是将化学能转化为电能 |
元素X、Y和Z可结合形成化合物;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是()
| A. | 是一种可溶于水的酸,且X与Y可形成共价化合物 |
| B. | 是一种微溶于水的盐,且X与Z可形成离子化合物 |
| C. | 是一种易溶于水的盐,且Y与Z可形成离子化合物 |
| D. | 是一种离子化合物,且Y与Z可形成离子化合物 |
设阿伏加德罗常数()的数值为,下列说法正确的是( )
| A. | 1 与足量 反应,转移的电子数为3 |
| B. | 1.5 与足量 反应,转移的电子数为 |
| C. | 常温常压下,46 的 和 混合气体含有的原子数为3 |
| D. | 0.10 粉与足量水蒸气反应生成的 分子数为0.10 |
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。
三氯甲硅烷()还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯制备高纯硅的化学反应方程式。
②整个制备过程必须严格控制无水无氧。遇水剧烈反应生成、和另一种物质,写出配平的化学反应方程式;
还原过程中若混入,可能引起的后果是。
(2)下列有关硅材料的说法正确的是(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅高温
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有、、、和等杂质,提纯工艺路线如下:

| 1. |
写出脱水反应的热化学方程式。 |
下列有关金属腐蚀与防护的说法正确的是()
①纯银器表面在空气中因化学腐蚀渐渐变暗②当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用③在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法④可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:+ ,电池的正极材料是,负极材料是石墨,含U导电固体为电解质。下列有关电池说法正确的是()
,电池的正极材料是,负极材料是石墨,含U导电固体为电解质。下列有关电池说法正确的是()
| A. | 可加入硫酸以提高电解质的导电性 |
| B. | 放电时电池内部 向负极移动. |
| C. | 充电过程中,电池正极材料的质量减少 |
| D. | 放电时电池正极反应为: + + = |
下列实验能达到预期目的的是( )
| A. | 向煮沸的1 溶液中滴加 饱和溶液制备 胶体 |
| B. | 向乙酸乙酯中加入饱和 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
| C. | 称取19.0 ,用100 蒸馏水溶解,配制1.0 溶液 |
| D. | 检验葡萄糖,应用氢氧化铜粉末,加热检验。 |
用铜片、银片、溶液、溶液、导线和盐桥(装有琼脂-的U型管)构成一个原电池。以下有关该原电池的叙述正确的是()
①在外电路中,电流由铜电极流向银电极
②正极反应为:
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
某探究小组用与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用浓度为1.00 ·、2.00 ·,大理石有细颗粒与粗颗粒两种规格,实验温度为298 、308 ,每次实验的用量为25.0 、大理石用量为10.00 。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
大理石规格 |
浓度/· | 实验目的 |
|
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
||||
| ③ |
||||
| ④ |
(2)实验①中质量随时间变化的关系见下图:
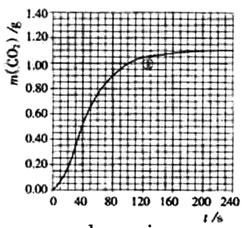
依据反应方程式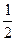 +=
+=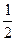 +
+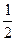 ↑+
↑+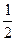 ,计算实验①在70-90 范围内的平均反应速率(忽略溶液体积变化,写出计算过程)。
,计算实验①在70-90 范围内的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中质量随时间变化关系的预期结果示意图。
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3、3% 、6 、0.01、稀溶液、0.1、20% 、蒸馏水。
①提出合理假设:
假设1:;
假设2:;
假设3:。
②设计实验方案证明你的假设(不要在答题卡上作答)。
③实验过程:
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| … |
科学家一直致力研究常温、常压下"人工围氮"的新方法。曾有实验报道:在常温、常压、光照条件下,在催化剂(掺有少量的)表面与水发生反应,生成的主要产物为。进一步研究生成量与温度的关系,部分实验数据见下表(光照、压力1.0×105Pa、反应时间3 h):
| T/K |
303 |
313 |
323 |
353 |
| 生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
回答下列问题:
(1)请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程
中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
高其反应速率且增大生成量的建议:。
(3)工业合成氨的反应为。设在容积为2.0L的密闭容器中充入0.60mol (g)和1.60 mol (g).反应在一定条件下达到平衡时,NH3的物质的量分数(的物质的量与反应体系中总的物质的量之比)为。计算
①该条件下的平衡转化率;②该条件下反应的平衡常数。
某些高分子催化剂可用于有机合成。下面是一种高分子催化剂(Ⅶ)合成路线的一部分(Ⅲ和Ⅵ都是Ⅶ的单体;反应均在一定条件下进行;化合物Ⅰ-Ⅲ和Ⅶ中含N杂环的性质类似于苯环):
 回答下列问题:
回答下列问题:
(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式(不要求标出反应条件)。
(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是(填字母)。
A.化合物Ⅰ可以发生氧化反应
B.化合物Ⅰ与金属钠反应不生成氢气
C.化合物Ⅱ可以发生水解反应
D.化合物Ⅲ不可以使溴的四氯化碳深液褪色
E.化合物Ⅲ属于烯烃类化合物
(3)化合物Ⅵ是(填字母)类化合物。
A.醇 B.烷烃 C.烯烃 D.酸 E.酯
(4)写出2种可鉴别V和M的化学试剂 。
(5)在上述合成路线中,化合物Ⅳ和V在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式(不要求标出反应条件)。





 已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示: 粤公网安备 44130202000953号
粤公网安备 44130202000953号