700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
|
n(CO)/mol
|
n (H2O)/ mol
|
0
|
1.20
|
0.60
|
t1
|
|
0.20
|
t2
|
0.80
|
|
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g) 、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
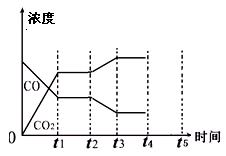
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
(6)若该容器绝热体积不变,不能判断反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆

