已知:1,3-丁二烯(CH2==CH—CH==CH2)与足量的氯气发生加成反应可以生成1,2,3,4-四氯乙烷(CH2Cl—CHCl—CHCl—CH2Cl)。现以氯苯为原料经以下步骤制取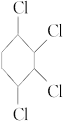 。
。

(1)①③步反应属于_________反应类型,B的结构简式为_________。
(2)②步反应所需的试剂和条件是__________________。
(3)写出④⑤两步的化学方程式: __________________、________________。
已知:1,3-丁二烯(CH2==CH—CH==CH2)与足量的氯气发生加成反应可以生成1,2,3,4-四氯乙烷(CH2Cl—CHCl—CHCl—CH2Cl)。现以氯苯为原料经以下步骤制取 。
。

(1)①③步反应属于_________反应类型,B的结构简式为_________。
(2)②步反应所需的试剂和条件是__________________。
(3)写出④⑤两步的化学方程式: __________________、________________。