臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g) + O3(g) N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 升高温度, 平衡常数减小 |
0~3 s内,反应速率为 v(NO2) =" 0.2" mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.v(A) = 0.7mol·L-1·min-1 B.v(B) = 0.3mol·L-1·min-1
C.v(C) = 0.9mol·L-1·min-1 D.v(D) = 1.1mol·L-1·min-1
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
可逆反应2A(g)+3B(g)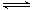 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5mol/(L·min) ②v(B)="0.6" mol/(L·min)
③v(C)="0.3" mol/(L·min) ④v(D)="0.4" mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.④ B.③ C.② D.①
5.6g铁粉投入到足量的100mL2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是
| A.v(Fe)=0.5mol/(L•min) | B.v(H2SO4)=1mol/(L•min) |
| C.v(H2)=0.5mol/(L•min) | D.v(FeSO4)=0.5mol/(L•min) |
在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是
| A.v(H2)=0.1mol·(L·min)-1 | B.v(N2)=0.1mol·(L·min)-1 |
| C.v(N2)=0.2mol·(L·min)-1 | D.v(NH3)=0.3mol·(L·s)-1 |
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)==H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0. 07 mol·L-1时,需要15 s,那么c(HI)由0. 07 mol·L-1 降到0.05 mol·L-1时,所需反应的时间为
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于l0 s |
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是:
| A.υ(H2)="0.1" mol·L-1·s-1 | B.υ(N2)="0.2" mol·L-1·min-1 |
| C.υ(NH3)="0.15" mol·L-1·min-1 | D.υ(H2)="0.3" mol·L-1·min-1 |
在2A + B =" 3C" + 4D的反应中,下列表示该反应速率最大的是( )
| A.VA =0.5mol / (L.min) | B.VB =0.3mol / (L.min) |
| C.VA =0.8mol / (L.min) | D.VD =" 1mol" / (L.min) |
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g) ⇌CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO2(g)和3 mol H2(g) |
1 mol CH3OH(g)和1 mol H2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4 kJ |
吸收a kJ |
请回答:
①c1 c2(填“>”、“<”或“=”);a = 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是 mol/(L·s)。
(2)压强为p1时,向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g) ⇌CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
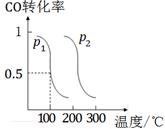
①该反应属于 (填“吸”或“放”)热反应;
p1 p2(填“>”、“<”或“=”)。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)。
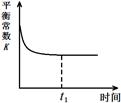
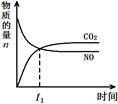
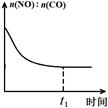
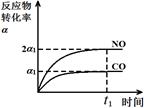
a b c d
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )

| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.当NaHSO3消耗时的离子方程式为:5HSO3-+2IO3-=5SO42-+I2+3H++H2O |
| C.图中a点对应的NaHSO3反应速率为5.5×10-5 mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该实验的指示剂 |
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)=" 0.40" mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
| A.反应速率υ(H2)=0.16mol•L-1•min-1 |
| B.容器体积扩大为4L,平衡向逆反应方向移动 |
| C.向体系中再充入1molH2,CO2的转化率增大 |
| D.此条件下该可逆反应的平衡常数的数值K=25 |