某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,填空:(4分)
(1)反应开始2min内的平均反应速率 = mol.(L.min)-1,
= mol.(L.min)-1,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
反应2SO2+O2 2SO3,在一段时间后c(SO3)增加了0.40mol·L-1 ,在这段时间内用O2表示的反应速率为0.040mol·L-1·s-1 ,则这段时间为( )
2SO3,在一段时间后c(SO3)增加了0.40mol·L-1 ,在这段时间内用O2表示的反应速率为0.040mol·L-1·s-1 ,则这段时间为( )
| A.0.10s | B.2.5s | C.5.0s | D.10s |
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
0 |
0 |
实验①和②探究 的影响;实验①和③探究 的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
对于可逆反应N2(g) + 3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.ν(H2)= 0.3mol/(L·min) | B.ν(N2)= 0.2mol/(L·min) |
C.ν(NH3)=" 0.25mol/(L·min" ) | D.ν(H2)= 0.4mol/(L·min) |
已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)。若化学反应速率分别用ν(NH3)、 ν(O2)、 ν(NO)、 ν(H2O)表示,则下列关系正确的是
| A.4ν(NH3)=5ν(O2) | B.5ν(O2)=6ν(H2O) |
| C.2ν(NH3)=3ν(H2O) | D.4ν(O2)=5ν(NO) |
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
| A.0.1 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.2 mol·L-1·min-1 | D.0.6 mol·L-1·min-1 |
某一反应物的浓度是2mol· L-1,经过4min后,它的浓度变成1. 68 mol· L-1,则在这4min内它的平均反应速率为( )
| A.0.2 mol· L-1 | B.0.1 mol· L-1 |
| C.0.04 mol· L-1 | D.0.08 mol· L-1 |
在一定温度下,固定容积的容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如右图所示:
(1)____________时(填t1、t2或者t3),正、逆反应速率相等,化学反应达到了平衡状态。
(2)计算0到t2时间内N的反应速率是____________。(用t2的式子表示)
(3)该反应的化学方程式为_____________________。
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
在1.0密闭容器中放入0.10molA(g)
,在一定温度进行如下反应应:

反应时间()与容器内气体总压强(
)的数据见下表:
| 时间 |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强 |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高的平衡转化率,应采取的措施为。
(2)由总压强和起始压强
计算反应物
的转化率
的表达式为。
平衡时的转化率为,列式并计算反应的平衡常数
。
(3)①由总压强和起始压强
表示反应体系的总物质的量
总和反应物
的物质的量
,
总=
,
=
。
②下表为反应物浓度与反应时间的数据,计算
=
| 反应时间 |
0 |
4 |
8 |
16 |
| 0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度变化与时间间隔(
)的规律,得出的结论是,
由此规律推出反应在12时反应物的浓度
为
。
溶液在不同温度下均可被过量
氧化,当
完全消耗即有
析出,根据
析出所需时间可以求得
的反应速率。将浓度均为0.020
(含少量淀粉)10.0
、
(过量)酸性溶液40.0
混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
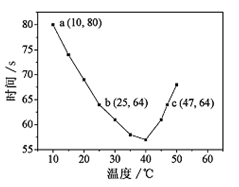
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B. |
图中
|
| C. |
图中
|
| D. | 温度高于40℃时,淀粉不宜用作该试验的指示剂 |
在N2+3H2 2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
| A.0.2mol/L·S | B.0.4mol/L·S |
| C.0.6mol/L·S | D.0.8mol/L·S |
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
对于A2+3 B2="=" 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.ν(B2)=" 0.8mol" /(L•s) B.ν(A2)=" 0.4mol" /(L•s)
C.ν(C)=" 0.6mol" /(L•s) D.ν(B2)=" 4.2mol" /(L•min)