下列叙述中正确的是
| A.摩尔是物质的质量的单位 |
| B.碳的摩尔质量为12g |
| C.阿伏加德罗常数约为6.02×1023mol﹣1 |
| D.气体摩尔体积为22.4L/mol |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.Fe在少量C12中燃烧生成0.5 mol产物,转移的电子数为1NA |
| B.78g Na2O2晶体中含有的阴离子数目为2NA |
| C.在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA |
| D.pH=13的NaOH溶液中含有的OH-的数目为0.1NA |
下列说法正确的是
| A.摩尔是用来衡量微观粒子多少的一种物理量 |
| B.在一定的温度和压强下,各种气体的摩尔体积相等 |
| C.阿伏加德罗常数的数值是0.012 kg 14C所含的原子个数 |
| D.若气体摩尔体积为22.4 L•mol﹣1,则所处条件为标准状况 |
实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液.以下仪器中,不需要用到的是
| A.烧杯 | B.玻璃棒 | C.容量瓶 | D.蒸馏烧瓶 |
配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是
| A.称量时,左盘高,右盘低 | B.定容时俯视读取刻度 |
| C.容量瓶洗净后未干燥 | D.定容时液面超过了刻度线 |
在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在__________式滴定管内,若用甲基橙作指示剂,达到滴定终点时,溶液从_________色变为____________色;
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第_____________种(填序号);
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO 3)表示,滴定时实验数据列表如下:
| 实验编号 |
待测盐酸体积(mL) |
滴入Na2CO3溶液体积(mL) |
| 1 |
20.00 |
18.80 |
| 2 |
20.00 |
16. 95 |
| 3 |
20.00 |
17. 05 |
根据以上数据计算时应带入的Na2CO3溶液体积_______________求这种待测盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=_________________。
常温下,A、B组成的混合气体(  )经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为
)经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为
①3∶4 ②2∶1 ③4∶1 ④4∶3 ⑤1∶2
A.只有⑤ B.①② C.④⑤ D.②④
下列溶液与20mL 1 mol·L—1 NaNO3溶液中NO3— 物质的量浓度相等的是
| A.10 mL 1 mol·L—1 Mg(NO3)2溶液 |
| B.5 mL 0.8 mol·L—1 Al(NO3)3溶液 |
| C.10 mL 2 mol·L—1 AgNO3溶液 |
| D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
①w=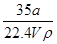 ×100%
×100%
②c=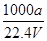
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)> c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
| A.①③ | B.②③ | C.②④ | D.①④ |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系
如右图。反应中镁和铝的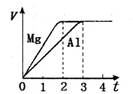
| A.物质的量之比为3:2 | B.质量之比为2:3 |
| C.摩尔质量之比为2:3 | D.反应速率之比为3:2 |