福建省四地六校高三上学期第一次联考化学试卷
根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的
| A.溶液 | B.悬浊液 | C.乳浊液 | D.胶体 |
血液属于胶体,透析是除去肾衰竭病人血液中的毒性物质、从而拯救病人生命的重要方法。透析的原理是
| A.蒸发 | B.电泳 | C.过滤 | D.渗析 |
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是
| A.蒸发 | B.分液 | C.过滤 | D.蒸馏 |
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是
| A.这个反应是氧化还原反应 | B.制造过程中元素种类没有改变 |
| C.另一种化合物为NaCl | D.金刚石属于金属单质 |
符合图中阴影部分的物质是
| A.Na2CO3 | B.Cu2(O H)2CO3 | C.NaCl | D.NaHCO3 |
苹果汁是人们喜爱饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
在炼铜的过程中发生:Cu2S+2Cu2O═6Cu+SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 |
| B.该反应从电子转移角度看,每生成6mol铜,转移电子12mol |
| C.该反应中,Cu2S既是还原剂又是氧化剂 |
| D.该反应中,氧元素氧化了硫元素 |
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液密度为q g/cm3(此过程中无溶质析出),物质的量浓度为c mol·L﹣1.则溶质的相对分子质量为
A. |
B. |
C. |
D. |
用下列实验装置进行相应实验,能达到实验目的的是

图1 图2 图3 图4
| A.用图1所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
| B.用图2所示装置,制备并收集少量NO2气体 |
| C.用图3所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图4所示装置,可以证明氧化性:Cl2>Br2>I2 |
下列各组中两种气体所含的原子数一定相等的是
| A.温度相同,体积相同的O2和N2 |
| B.质量相等,密度不等的N2和CO |
| C.体积相等,密度相等的CO和C2H4 |
| D.压强相同、体积相同的N2和O2 |
下列叙述中正确的是
| A.摩尔是物质的质量的单位 |
| B.碳的摩尔质量为12g |
| C.阿伏加德罗常数约为6.02×1023mol﹣1 |
| D.气体摩尔体积为22.4L/mol |
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
| A.实验过程中用pH试纸测定溶液的pH |
| B.a~b段,溶液中 C(H+)/C(OH-) 减小 |
| C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) |
| D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-) |
碘是一种与人的生命活动密切相关的元素,已知I2能溶于NaOH或KI溶液,反应方程式分别为:3I2+6OH﹣═5I﹣+IO3-+3H2O(HIO不稳定,易发生歧化反应)和I2+I﹣═I3-,溴化碘(IBr)是一种卤素互化物,具有与卤素单质相似的性质,下列反应方程式中不正确的是
| A.IBr加入Na2S溶液中产生黄色浑浊:IBr+S2﹣═I﹣+Br﹣+S↓ |
| B.IBr加入KI溶液中:IBr+2I﹣═Br﹣+ I3- |
| C.IBr加入NaOH溶液中:IBr+2OH﹣═BrO﹣+I﹣+H2O |
| D.IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+ IO3-+6H+ |
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质.转化流程如图所示:有关上述转化过程的下列叙述正确的是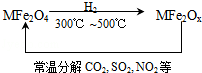
| A.MFe2O4表现了还原性 | B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 | D.SO2和NO2发生了分解反应 |
建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A.钠在氧气中燃烧,钠的氧化产物: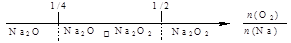 |
B.铁在Cl2中燃烧,铁的氧化产物: |
C.NH3与Cl2反应,反应产物: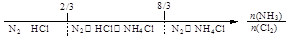 |
D.FeBr2溶液中通入Cl2,铁元素存在形式: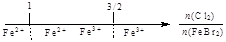 |
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”.工业上以金红石为原料制
取Ti的反应为Ⅰ. aTiO2 + bCl2 + eC  aTiCl4 + eCO
aTiCl4 + eCO
Ⅱ. TiCl4 + 2Mg  Ti + 2MgCl2
Ti + 2MgCl2
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e=2
⑤每生成19.2g Ti,反应Ⅰ、Ⅱ中共转移4.8mol e﹣.
A.①②④ B.②③④ C.②⑤ D.③④
NA表示阿伏加德罗常数,下列说法中正确的有
①20g D2O含有的电子数为10NA
②常温下,4g CH4含有NA个C﹣H共价键
③10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25℃时,pH=12的1.0L CH3COONa溶液中水电离出的OH﹣的数目为0.01NA
⑥1mol Na2O2与水完全反应时转移电子数为2NA.
| A.5个 | B.2个 | C.3个 | D.4个 |
某合作学习小组讨论辨析:
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤水玻璃、有色玻璃和果冻都是胶体
⑥ 汽油属于混合物,而液氯、冰醋酸均属于纯净物
⑦烟、雾、豆浆都是胶体
上述说法正确的是
| A.①②③⑤⑦ | B.③④⑤⑥ | C.②④⑤⑦ | D.①②④⑥⑦ |
计算:
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的是 ;标准状况下体积最大的是 。(填序号)
①1gH2; ②2.408×1023个CH4;③10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是 (用含NA的式子表示)。
(4)工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。

回答下列问题:
①制取无水氯化铁的实验中,装置B中加入的试剂是 。
②制取无水氯化亚铁的实验中若操作不当,制得的FeCl2会含有少量FeCl3,欲制得纯净的FeCl2,在实验操作中应先 ,再 。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为 ;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(5)若实验过程中出现如下情况如何处理:加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤(2))不慎有液滴掉在容量瓶外 。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
| 操 作 |
现 象 |
 |
I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 .
(2)A中溶液变红的原因是 .
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 .②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。甲同学的实验证明产生现象Ⅱ的原因是SCN﹣与Cl2发生了反应.
(4)甲同学猜想SCN﹣可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN﹣的电子式为 。
。
①甲同学认为SCN﹣中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN﹣ 中被氧化的元素是 .
③通过实验证明了SCN﹣中氮元素转化为NO3﹣,他的实验方案是 .
④若SCN﹣与Cl2反应生成1mol CO2,写出反应离子方程式 并计算转移电子的物质的量是 mol。
铬是水体的主要的污染物之一,可以导致水生生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下:

(1)在上图所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式 。
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸,可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是__________、 。 (写化学式)
(3)铬的化合价除了示意图中涉及的+3和+6外,还有0、+2、+4和+5等。
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO4被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 。
(4)步骤⑤应该加入________剂(填“还原”或“氧化”)。
 点燃酒精灯
点燃酒精灯 蒸馏
蒸馏 过滤
过滤 稀释浓硫酸
稀释浓硫酸 粤公网安备 44130202000953号
粤公网安备 44130202000953号