已知NaOH与NaHCO3发生反应的方程式为:
Ⅰ.实验室用氢氧化钠固体配制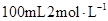 的NaOH溶液,回答下列问题:
的NaOH溶液,回答下列问题:
(1)下列操作的顺序是(每项限选一次)_____________。
| A.称量 |
| B.溶解 |
| C.洗涤 |
| D.定容 |
E.转移
F.摇匀
G.冷却
(2)若容量瓶中有少量蒸馏水,所配溶液的浓度将_____________;(填“偏大”、“偏小”或“无影响”)
(3)在定容操作时,俯视容量瓶刻度线,则所配溶液的浓度将_____________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.在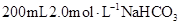 溶液中加入一定量的常见纯净物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,请回答下列问题:
溶液中加入一定量的常见纯净物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,请回答下列问题:
(1)请填写下表空白。
| 编号 |
① |
② |
③ |
④ |
| X的化学式 |
|
NaOH |
Na2O2 |
|
| 加入X的质量(g) |
9.2 |
|
15.6 |
|
(2)反应后,溶液中的Na+的物质的量均为_____________mol。
(3)在①~④中,所得Na2CO3溶质的质量分数相等的是_____________(填编号)。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式__________________________
(2)通过计算确定y与a、x的函数关系式____________________
(3)若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为___;其物质的量之比为________________。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中会分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量酸,该酸最好是 。运用化学平衡原理以及离
方程式简述该酸的作用 。
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 =2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
(12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg∙L-1 |
9360 |
83 |
160 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。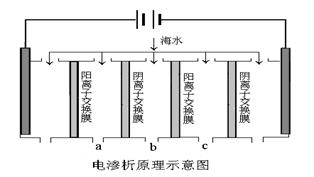
① 开始时阳极的电极反应式为 。
② 电解一段时间, 极(填“阴”或“阳”)会产生水垢,其成份为 (填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示: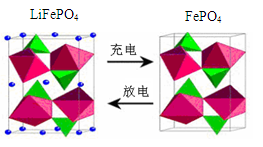
该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示 (填粒子符号),充电时该电极反应式为 。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为 (空气中氧气的体积分数按20%计)。
填空题
(1)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体)。将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红。请根据以上事实书写CaH2与水反应的化学方程式_____________________________________。
(2)实验室可用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
①该反应的还原剂是 ,氧化剂与还原剂的物质的量比是______________。被氧化的元素是_______________,还原产物是 。
②若反应中转移了NA个电子,则生成的Cl2在标准状况下的体积是 。
③实验室用12.00 mol/L盐酸配制100mL 1 mol/L 盐酸,需要的玻璃仪器除了烧杯、量筒、玻璃棒,还有____________。若定容时俯视刻度线,则配得溶液的浓度___________(填“偏高”,“偏低”,“不变”)。
(6*1分)下面是用98%的浓H2SO4(ρ="1.84" g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为 。
(2)所需浓H2SO4的体积为 。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的 里,并不断搅拌。
(4)冷却后,将上述溶液转移到 中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平,摇匀。
取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下)。
(1)写出上述过程中发生的离子方程式_______________________________________
________________________________________________________________________。
(2)计算原混合液体中,硫酸物质的量浓度是_________________mol/L,盐酸物质的量浓度是_____________________mol/L(写出计算过程)。
(12分)某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: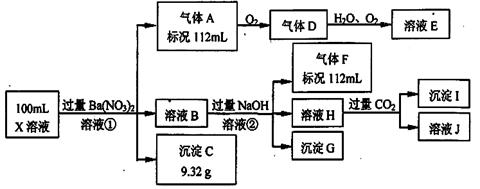
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
(2)用离子方程表达下列反应:
①中生成气体A:___________ __。
②中生成溶液H:____________ _。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
某同学欲配制85mL 0.10 mol/L CuSO4溶液。
(1)若用100 mL容量瓶配制该溶液,应称取胆矾晶体(CuSO4.5H2O)的质量为 g。
(2)在配制过程中,该同学已经有天平(带砝码)、药匙、100 mL容量瓶、玻璃棒、胶头滴管,要完成该实验还缺少的仪器是 。
(3)下列情况中,能使所配溶液的物质的量浓度偏高的是 。
| A.称量固体时将砝码放置在托盘天平左盘 |
| B.胆矾已失去部分结晶水 |
| C.转移溶液时有少量液体流出容量瓶外面 |
| D.定容时俯视刻度线 |
实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)用托盘天平称取十水合碳酸钠晶体(Na2CO3·10H2O) g。
(2)配制500mL0.1mol/L Na2CO3溶液时需用的主要仪器有托盘天平(带砝码、摄子)、烧杯、玻璃棒、 、
等。
(3)若实验遇下列情况,则溶液的浓度可能会发生变化,在下列问题中选择填空:
A(偏高)
B(偏低)
C(不变)
①忘记将洗涤液转入容量瓶_______;②若该物质溶于水放热,溶解后没有冷却便转入容量瓶进行定容 ;③加水定容时超过刻度线_______。
下图为向100 mL 2 mol/L AlCl3溶液中加入2 mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为1∶ 。
(2)AB段曲线所表示的反应的离子方程式是___________________。
(3)B点对应溶液中存在的物质的量浓度最大的离子是 (填离子符号);若向B点对应溶液中通入二氧化碳气体,可见到的现象是 。
(4)当该AlCl3溶液中产生7.8 g沉淀时,消耗2 mol/L NaOH溶液的体积可能是多少?(写计算过程)
将1.05 g由铝和过氧化钠的混合物放入一量的水中,充分反应后固体无剩余。再向其中慢慢滴加50 mL 1 mo1/L的盐酸,可恰好使反应过程中产生的沉淀溶解。
(1)要使混合物溶于水无剩余,则n(Al) 与 n(Na2O2)的关系须满足 ;
(2)写出沉淀溶解的离子方程式: ;
(3)求原混合物中铝、过氧化钠的质量;
(4)求滴加盐酸过程中开始出现沉淀时盐酸的体积。
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答:
(1)AB段所表示的反应的离子方程式是 ;
CD段所表示的反应的离子方程式是 。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是 。
(3)a是______________,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)= _____________________
_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
试通过计算确定400℃剩余固体成分的化学式 。(写出计算过程)
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.有反应Al2O3(s)+ Na2CO3(s)
 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| |
Al2O3 |
Fe2O3 |
Na2O |
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:
得到的赤泥 t(精确到0.001,下同);
可制得Al2O3得 t;
需要补充购买Na2CO3 kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;b= (精确到0.001).