现有装有物质的量浓度为1.2 mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲.乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A.1.08克 | B.1.44克 | C.1.8 克 | D.无法计算 |
设NA表示阿伏加德罗常数的值.下列叙述正确的是
| A.13.8gNO2与足量水反应,转移电子数目为0.2NA |
| B.标准状况下,22.4L溴苯中含有氢原子数目为5NA |
| C.500mL2mol/LNH4NO3溶液中,含有NH4+数目为NA |
| D.用惰性电极电解足量CuSO4溶液,生成22.4L气体时转移电子数目为4NA |
在一定条件下,将m体积NO和n体积O2同时倒立于水中且盛满水的容器内,充分反应后,容器内残留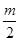 体积的气体,该气体与空气接触后变为红棕色。则m与n的比值为
体积的气体,该气体与空气接触后变为红棕色。则m与n的比值为
| A.3:2 | B.2:3 | C.8:3 | D.3:8 |
下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数)
| |
二氧化碳 |
碳酸钠 |
转移的电子 |
| A |
0.5mol |
|
NA |
| B |
|
53g |
0.5mol |
| C |
|
53g |
NA |
| D |
11.2L |
0.5mol |
|
A.A B.B C.C D.D
NA为阿伏加德罗常数的值。下列说法中,正确的是
| A.标准状况下,22.4L庚烷的分子数约为NA |
| B.密闭容器中23gNO2与N2O4的混合气体中氮原子数为0.5NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
| D.1L0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:

(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
下列各组实验中溶液最先变浑浊的是( )
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A.在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L |
| B.5.6g铁与足量的氯气反应,转移电子数为0.2NA |
| C.11.2LH2O所含有的原子数为1.5NA |
| D.0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
由乙醛和丁酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含碳的质量分数为( )
| A.6A%/7 | B.(1-A%)/7 | C.6(1-A%)/7 | D.(100-7A/6)% |