在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:

(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% | C.30.0% | D.80.6% |
下列各组实验中溶液最先变浑浊的是( )
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
与50 mL 0.2 mol / L NH4Cl溶液中的NH4+浓度相同的是
| A.50 mL 0.2 mol / L CH3COONH4溶液 |
| B.50 mL 0.25 mol / L (NH4)2SO4溶液 |
| C.100 mL 0.2 mol / L NH4NO3溶液 |
| D.50 mL 0.2 mol / L NH3·H2O |
在一支25ml的酸式滴定管中盛入0.1mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
| A.大于20 mL | B.小于20 mL | C.等于20 mL | D.等于5mL |
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。
下列叙述中,正确的是
| A.标准状况下,Cl2的摩尔质量为71g |
| B.氧化还原反应一定有氧元素参加 |
| C.标准状况下,1molCCl4的体积是22.4L |
| D.Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
用NA表示阿伏加德罗常数的值.下列说法正确的是
| A.常温常压下,l1.2 LHCl中含有的分子数目为0.5NA |
| B.NA个氢分子和NA个氧分子的质量比为1:16 |
| C.标准状况下,22.4 L水中含有的分子数目为NA |
| D.1 molCl2与足量的铁反应转移的电子数目是NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA |
| B.64g SO2含有NA个SO2分子 |
| C.16g CH4所含的电子数为NA |
| D.标况下,4.48L的水中含有H2O分子的数目为0.2NA |
在标准状况下,将wgA气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为mol/L.
A.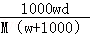 |
B.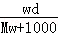 |
C.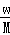 |
D.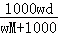 |
过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数)
| |
二氧化碳 |
碳酸钠 |
转移的电子 |
| A |
0.5mol |
|
NA |
| B |
|
53g |
0.5mol |
| C |
|
53g |
NA |
| D |
11.2L |
0.5mol |
|
A.A B.B C.C D.D
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①标准状况下,含NA个氩原子的氩气体积约为22.4L
②34gH2O2中含有的阴离子数为NA
③常温常压下,21g氧气和27g臭氧中含有的氧原子总数为3NA
④在Fe参与的反应中,1molFe失去的电子数为3NA
⑤标准状况下,11.2L的Cl2溶于水,转移的电子总数为0.5NA
⑥在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
⑦1L1mol·L-1NH4NO3溶液中氮原子数小于2NA
⑧标准状况下,22.4LCCl4中所含有的分子数为NA
| A.①②⑤ | B.①⑥⑧ | C.①③ | D.③④ |
下列物质的溶液中分别滴加Ba(OH)2溶液至过量,反应产生的沉淀的质量(m)或物质的量(n)随加入的Ba(OH)2溶液体积关系图像正确的是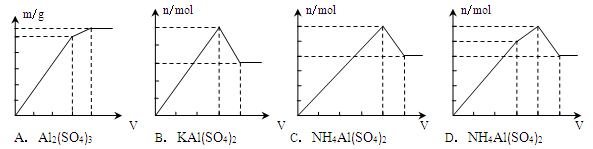
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A.在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L |
| B.5.6g铁与足量的氯气反应,转移电子数为0.2NA |
| C.11.2LH2O所含有的原子数为1.5NA |
| D.0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |