明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: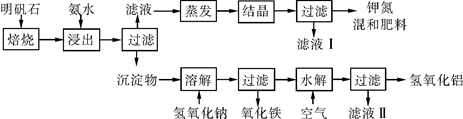
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)写出沉淀物中所有物质的化学式:____________________。
(3)滤液Ⅰ的成分是水和________________________________。
(4)为测定混合肥料 K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
④若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为___________mol(用含m、n的代数式表示)。
(10分)掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置。

(1)写出下列仪器的名称:
① ② ④ ;
(2)仪器①~④中,使用时必须检查是否漏水的是:(填序号) 。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;该实验操作过程中需要通入冷却水,通入的方向是 (g或f)口进水, (g或f)口出水。
(4)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。

实验室要用98%(密度为1.84 g·cm-3)的硫酸配制3.68 mol/L的硫酸500 mL。
若配制3.68 mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是___。
| A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
(6分)溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100g10%的氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒和 __________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度溶液,试叙述定容操作的具体方法:向容量瓶中注入蒸馏水至离刻度线1~2cm处,然后________________________________。
28.用18mol/L 浓硫酸配制100 ml 1.0mol/L 稀硫酸的实验。回答下列问题:
(1)所需浓硫酸的体积是 mL(保留一位小数);
(2)现有下列几种规格的仪器,应选用
①10mL量筒 ②50 mL量筒 ③100mL量筒 ④100mL容量瓶 ⑤250mL容量
(3)下列情况对所配制的稀硫酸浓度有何影响?(填写“偏大”、“偏小”或“无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ;
②容量瓶用蒸馏水洗涤后没干燥就开始移液 ;
③量取浓硫酸时俯视量筒刻度线 ;
④定容时俯视容量瓶刻度线 ;
(各2.5分,共5分).取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标况下),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
下图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题:
(1)写出仪器C、E的名称 、
(2)分离以下混合物应该主要选用使用什么仪器?( 填字母符号)
填字母符号)
粗盐和泥沙: 花生油和水:
(3)计算标签上硫酸的物质的量浓度为 
(6分)(1)用18.0 mol/L H2SO4配制100 mL 1.00mol/L H2SO4,则需要的实验仪器除了烧杯、玻璃棒、胶头滴管以外还应该有:______
配制过程中,下列情况会使配制结果偏高的是(填序号)____
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)_________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C .配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀
右图为实验室某浓盐酸试剂瓶标签上的有关数据,
试根据标签上的有关数据回答下列问题:
⑴该浓盐酸中HCl的物质的量浓度为 mol·L-1。 ⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
| A.溶液中HCl的物质的量 | B.溶液的浓度 | C.溶液中Cl-的数目 | D.溶液的密度 |
(8分)下图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。将上述硫酸进行稀释的实验操作是_____________________。
(3)在配制4.6 mol/L的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中________;
②容量瓶用1 mol/L稀硫酸润洗________;
③定容时仰视观察液面________。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析原因______________________。
实验室欲配制90mL浓度为1.00mol·L-1的Na2CO3溶液:
(1)配制时的实验步骤为:计算、称量、溶解、转移(洗涤)、 ▲ 、摇匀;
(2)本实验中必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、量筒、胶头滴管、
▲ (注明所需仪器的规格)。
(3)某同学欲称量Na2CO3的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为 ▲ g,要完成本实验该同学应称出 ▲ g Na2CO3。
(4)使用容量瓶前必须进行的一步操作是 ▲ 。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①没有洗涤烧杯和玻璃棒 ▲ ;②容量瓶不干燥,含有少量蒸馏水 ▲ ;
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室里从海藻灰中提取碘的流程如图所示。
(1)提取碘的过程中有关操作名称__________________________________。
(2)写出得到碘的离子方程式______________________________________。
(3)提取碘的过程中可以选择的有机试剂是__________________________。
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、导管、圆底烧瓶、石棉网和必要的夹持仪器和物品,尚缺少的玻璃仪器是_______________________。
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时的一个错误是____________________,烧杯的实际质量为_______________g。
(2)指出下面实验中各存在的两个错误:
A.需配制150 mL 0.2 mol·L-1NaCl溶液,右图是该同学转移溶液的示意图。
_______________________________________________________________________。
B.除去氯气中的氯化氢气体:
_______________________________________________________________________。
(3)用98%密度为1.84 g·cm-3的浓硫酸配制1 000 mL 0.1 mol·L-1稀硫酸。
①应用量筒量取浓硫酸___________________mL。
②配制硫酸溶液时需要用到的仪器有________________。(除量筒外,写出其余四种)
③下列操作结果,所配溶液物质的量浓度偏低的是________________。
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.定容时仰视观察液面
D.摇匀后立即观察,发现溶液未达刻度线,再用滴管加几滴蒸馏水至刻度线
下图中,(1)图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是_________________mL。
(2)图Ⅱ表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)_____________________。
| A.是a mL | B.是(50-a)mL |
| C.一定大于a mL | D.一定大于(50-a)mL |
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,操作步骤有:①在天平上称取27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水把它完全溶解。②把制得的溶液小心地注入500 mL容量瓶中。③继续向容量瓶中加入蒸馏水,至液面距刻度1 cm—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号):____________________________________________。
(2)本实验用到的基本仪器有:__________________________________________________。
(3)若俯视刻度,对所配制溶液浓度的影响是______________(填“偏低”“偏高”或“无影响”)。
(4)若没有进行④的操作,其影响是________________________________________________。
(5)若实验中出现了下列情况应如何处理:加蒸馏水时不慎超过了刻度,应________________,向容量瓶中转移溶液时(实验步骤②)不慎有液滴溅在容量瓶外面,应____________________。