下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.往K2CrO4溶液中加酸,使溶液橙色加深 |
| D.Fe(SCN)3溶液中加入几滴6mol/L NaOH溶液后溶液颜色变浅 |
在一个6 L的密闭容器中放入3 L X气体和2 L Y气体,在一定条件下发生下列反应:4X(g)+3Y(g)  2Q(g)+nR(g)当反应达平衡后,容器内温度不变,混合气体的压强比原来增大5%,X的浓度减小
2Q(g)+nR(g)当反应达平衡后,容器内温度不变,混合气体的压强比原来增大5%,X的浓度减小 ,则该反应式中n的值为
,则该反应式中n的值为
| A.3 | B.4 | C.5 | D.6 |
碘单质难溶于小却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.对于可逆反应N2(g)+3H2(g) 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
反应:xA(气)+yB(气)  zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
| A.x+y<z | B.平衡向右移动 |
| C.B的转化率升高 | D.C的体积分数降低 |
已知 (CH3COOH)2 (g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(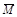 =
=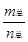 )随温度(T)的变化曲线如图所示,下列说法正确的是
)随温度(T)的变化曲线如图所示,下列说法正确的是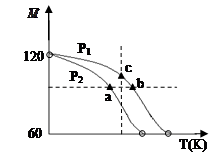
| A.该过程的△H < 0 |
| B.气体压强:P(a) < P(b) = P(c) |
| C.平衡常数:K(a) =" K(b)" < K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)  2C(g),可以判断达到化学平衡状态的是( )
2C(g),可以判断达到化学平衡状态的是( )
| A.体系压强不变 | B.单位时间消耗n molA,同时生成2nmolC |
| C.A的转化率不变 | D.容器内气体密度不变 |
在一密闭恒容容器中发生如下反应:aX(g)+bY(g)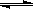 cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大 |
| B.若通入稀有气体平衡不移动,则a+b=c |
| C.若加入催化剂,反应速率改变,但平衡不移动 |
| D.若增加X的量,平衡正向移动,X的转化率增大 |
一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
| A.用M表示此反应的反应速率γ(M)="0.1a" mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入l mol X,平衡正向移动,因为此时γ正增大,γ逆减小 |
反应2X(g)+Y(g) 2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示
2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示
则下列判断正确的是
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
COCl2(g) CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。(不考虑NO2与N2O4的转化)

(1)开始时左右两室分子数 (填“相同”或“不相同”)。
(2)反应前后NO室压强 (填“增大”或“减小”) 。
(3)最终容器内密度与原来 (填“相同”或“不相同”)。
(4)最终容器内 (填“有”或“无”)O2存在。
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面 合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g)  CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是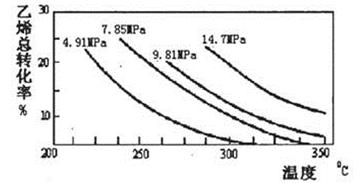
| A.合成乙醇的反应一定为吸热反应 |
| B.目前工业上釆用250〜300℃,主要是在此温度下乙烯的转化率最大 |
| C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率 |
| D.相同催化剂下,在300℃14.7MPa乙醇产率反而比300℃7MPa低得多,是因为加压平衡向逆反应方向移动 |