反应2X(g)+Y(g)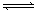 2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示
2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示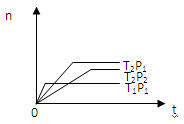
则下列判断正确的是
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
反应2X(g)+Y(g)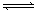 2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示
2Z(g);在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示
则下列判断正确的是
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |