碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)

氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
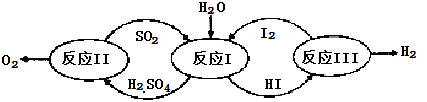
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用进行分离。该产物的溶液在过量
的存在下会分成两层--含低浓度
的
层和高浓度的
的
层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加前,
溶液和HI溶液不互溶
c.在
溶液中比在
溶液中易溶
②辨别两层溶液的方法是。
③经检测,层中
=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:
它由两步反应组成:i.
ii.分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中的平衡转化率随X的变化关系。
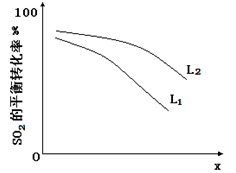
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
(14分)苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g)  C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8 kJ.mol
H)分别为-285.8 kJ.mol 和-283.0 kJ.mol
和-283.0 kJ.mol ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1
H=+114.8 kJ·mol-1
则制取苯乙烯反应的 H为_________
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
| A.升高温度,正反应速率减小,逆反应速率增大 |
| B.若继续加入1 mol乙苯,苯乙烯转化率增大 |
| C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 |
| D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气, |
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700 时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970
时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970 时,苯乙烯的产率不再增加,其原因可能是_________。
时,苯乙烯的产率不再增加,其原因可能是_________。
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为_________,若去除0.5 mol苯乙烯,两极共收集气体_________mol。
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如右图:
①该反应的热化学方程式为 .
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K .
| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)
H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l) H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:
①合成尿素总反应的快慢由第 步反应决定.
②反应进行到10 min时测得 CO2 的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:
a. ;
b. .
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。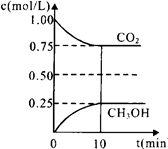
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使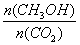 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。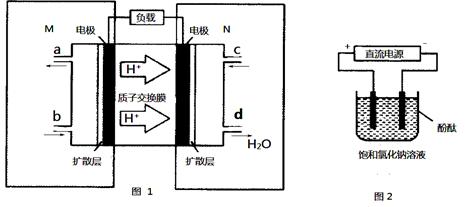
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: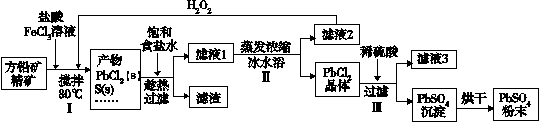
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
| Ksp |
|
开始沉淀时pH |
完全沉淀时pH |
|
| PbSO4 |
1.08×10-8 |
Fe (OH)3 |
2.7 |
3.7 |
| PbCl2 |
1.6×10-5 |
Pb(OH)2 |
6 |
7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式_______,加入盐酸控制pH值小于2,原因是_______。
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因______。若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______。
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式______。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因______。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为_______。
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是____。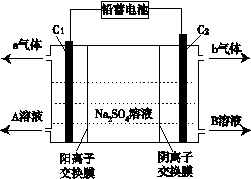
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
(7分) 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。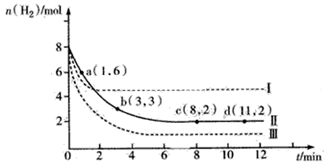
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 。
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是_______。
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅲ对应的实验条件改变是 。
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)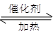 2NH3(g),ΔH<0
2NH3(g),ΔH<0
①该反应的平衡常数K的表达式为:K=___________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式 。
已知NO2和N2O4之间发生可逆反应: 2NO2 (g) (红棕色) N2O4(g) (无色)
N2O4(g) (无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。
分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中 。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生 。
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2 气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是 。
气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是 。
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。
①表示NO2变化的曲线是 (填“X”或“Y”)。
②在0到1 min内用Y的浓度变化表示的该反应的
反应速率是 mol·L-1·min-1
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
①应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)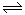 SO2Cl2(g)△H
SO2Cl2(g)△H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)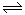 2SOCl2(g)△H1=-akJ/mol
2SOCl2(g)△H1=-akJ/mol
②SO2Cl2(g)+SCl2(g)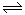 2SOCl2(g)△H2=-bkJ/mol(a>b>0)
2SOCl2(g)△H2=-bkJ/mol(a>b>0)
则△H=________kJ/mol(用a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是________(填字母序号)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1 时刻反应达到平衡状态的是(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将n molSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P。起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则υ(SO2)= _________。
②此温度下,该反应的K=_________。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_________。
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式_______________;已知 于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应: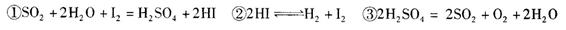
(1)分析上述反应,下列判断正确的是____。
a. 循环过程中产生1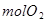 的同时产生
的同时产生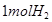
b. 反应①中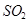 还原性比
还原性比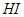 强
强
c. 循环过程中需补充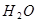
d. 反应③易在常温下进行
(2)在一定温度下,向2L密闭容器中加入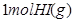 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。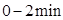 内的平均反应速率
内的平均反应速率
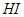 的转化率=_______
的转化率=_______
(3)恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。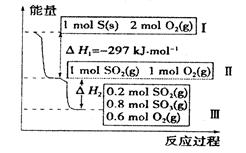
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和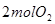 充分反应,放出热量的数值比
充分反应,放出热量的数值比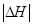 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅(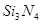 )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)该反应平衡常数的表达式为K=_______.升高温度,其平衡常数_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示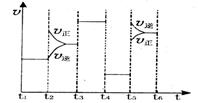
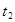 时引
时引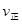 起突变的原因是_____,
起突变的原因是_____,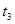 引起变化的因素是_____,
引起变化的因素是_____,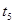 时引
时引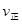 小变化、
小变化、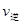 大变化的原因是_________.
大变化的原因是_________.
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: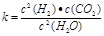 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A.=0.8mol·L-1 B.=1.4mol·L-1
C.<1.4mol·L-1 D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A.0.6mol1.0mol0.5mol1.0mol
B.0.6mol2.0mol0mol0mol
C.1.0mol2.0mol1.0mol2.0mol
D.0.25mol0.5mol0.75mol1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)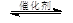 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
CO2和CH4是两种重要的温室气体.通过CH4和CO2反应可以制造价值更高的化学品。
(1)25℃时.以镍合金为催化剂,向4L容器中通人6 mol CO2,4mol CH4,发生反应:
CO2(g)+CH4(g)  2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为____________.
②已知①CH4(g)+2O2(g)=CO2(g)+2H2O (g) ΔH= -890.3KJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= +2.8KJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH= -566.0KJ/mol
求反应CO2(g)+ CH4(g) 2CO(g) +2H2(g)的ΔH=___________KJ/mol
2CO(g) +2H2(g)的ΔH=___________KJ/mol
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4(g) CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题:
CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题: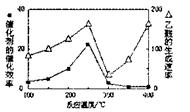
①250-3000C时,温度升高而乙酸的生成速率降低的原因是 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2条)。
(3)Li4SiO4可用于吸收、释放CO2,原理是,5000C时CO2与Li2SiO4接触生成Li2CO3;平衡后加热至7000C ,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件): 。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物.多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。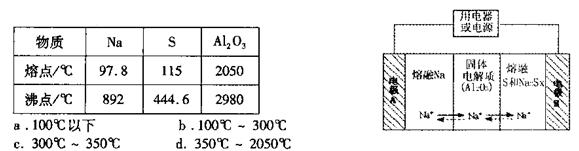
②放电时电极A为 极。
③充电时,总反应为Na2Sx="2Na+xS" (3<x<5).则阳极的电极反应式为 。
(14分)硝酸厂废气、汽车尾气中的氮氧化物可污染大气,现有几种消除氮氧化物的方法如下:
目前,消除氮氧化物污染有多种方法。
(1)方法一:CH4催化还原法。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
现有一混合气体中NO与NO2的体积比为3:1,用22.4L(标准状况下)甲烷气体催化还原该混合气体,恰好完全反应(已知生成物全部为气态),并放出1042.8KJ的热量,则ΔH2为_____________;写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)方法二:活性炭还原法。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,只生成甲和乙,甲和乙均为参与大气循环的气体,且反应进行到不同时间测得各物质的浓度如下:
由以上信息可知:
①该原理的化学方程式为____________________________________________________.
②该温度下的平衡常数K=_____________________________。(保留小数点后两位有效数字)
③若20min后升高温度至T2℃,达到平衡后,若容器中NO、甲、乙的浓度之比为1:1:1,则该反应的ΔH_____0 。(填">"、"<"、"=")
(3)方法三:NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
(4)方法四:ClO2氧化氮氧化物。其转化流程如下:
已知反应Ⅰ的化学方程式为2NO+ ClO2+ H2O = NO2+ HNO3+ HCl,则反应Ⅱ的化学方程式是 。