四川省南充市高三第三次高考适应性考试理综化学试卷
化学与生产、生活密切相关,下列说法正确的是
| A.淀粉溶液、豆浆、雾和饱和食盐水均可发生丁达尔现象 |
| B.氮化硅(Si3N4)、氧化铝(Al2O3)、碳化硅(Sic)和二氧化锆(ZrO2)都可用作制高温结构陶瓷的材料 |
| C.绿色化学的核心是利用化学原理治理环境污染 |
| D.光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关 |
下列表示对应化学反应的离子方程式正确的是
①将过量SO2气体通入氨水中SO2+NH3·H2O=NH4++HSO3-
②用铁电极电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
③向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3+2H2O+CO32-
④钢铁发生吸氧腐蚀正极的电极反应:2H2O+O2+4e-=4OH-
⑤硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO+6H2O
| A.②③⑤ | B.①③⑤ | C.①④⑤ | D.②④⑤ |
仅用下表提供的仪器和药品,就能达到相应实验目的的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 |
NaCl固体、蒸馏水 |
配制一定质量分数的NaCl溶液 |
| B |
分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 |
盐酸、大理石、硅酸钠溶液 |
证明非金属性:Cl>C>Si |
| C |
酸式滴定管、胶头滴管、铁架台(带铁夹) |
已知浓度的盐酸、待测NaOH溶液 |
测定NaOH溶液的物质的量浓度 |
| D |
烧杯、分液漏斗、胶头滴管、铁架台 |
待提纯的AlCl3溶液、NaOH溶液 |
提纯混有MgCl2杂质的AlCl3溶液 |
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是
| A.原子半径W>Z>Y>X>M |
| B.将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| C.由X、Y、Z、M四种元素共同形成的化合物中一定有共价健可能有离子键 |
| D.CaX2、CaM2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
一在密闭容器中进行反应CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
| A.0~5min内,v(H2)=0.1mol/L·min |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时.改变的外界条件可能是升高温度 |
下列有关电解质溶液中徽粒的物质的量浓度关系正确的是
| A.在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1mol/LNa2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LnaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7,c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
根据下列各图曲线表征的信息,得出的结论不正确的是
| A.图l表示常温下向体积为10 mL 0. 1 mol•L-1NaOH溶液中逐滴加入0. 1 mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸.II表示盐酸,且溶液导电性:c>b>a |
| C.图3表示H2与O2发生反应过程中的能量变化,H2的然烧热为285. 8kJ mol-1 |
| D.由图4得出若除去CuSO4洛液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的PH至4左右 |
硼元素、钙元索、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl榕液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 。其在酸性溶液中不跪定,可发生歧化反应生成Cu2十和Cu,但CuO在高温下会分解成Cu2O,
试从结构角度解释高温下CuO为何会生成Cu2O: 。
②CaC2中C22-与O22+互为等电子体.1molO22+中含有的π键数目为 。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH一C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ,构成丙烯腈元素中第一电离能最大的是 (填元素符号)。
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图〕.则1 mo1H3BO3的晶体中有 mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为
(3)Cu3N的晶胞结构如图,N3-的配位数为 。Cu+半径为a cm,N3-半径为bcm,Cu3N的密度为___ g/cm3,(阿伏加德罗常数用NA表示)
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)捡验这种新型洗涤剂中金属阳离子的操作和现象是 。
(2)这种洗涤剂中的双氧水可以将废水中的CN-转化为无毒物的同时生成NH3,写出该反应的离子方程式 。
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至会完全失去杀菌作用。试分析其中可能的原因(写出其中一种即可,用反应(离子)方程式和简要文字表述) 。
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0. 1 mol•L-1NaOH溶液、8 mol•L-1 NaOH溶液、澄清石灰水、0.10mol·L-1KMnO4溶液,BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气休成分提出合理假设。
假设l:气体是O2:。 假设2:气体是CO2。 假设3:气体是
②设计方案:设计实验方案证明假设3,在下表中完成实验步脚、预期现象和结论。
H是一种新型香科的主要成分之一,其结构中含有三个六元环. H的合成路线如下(部分产物和部分反应条件路去):
己知:①B中核磁共振里谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出F与足量氢氧化钠溶液在加热条件下反应的化学方程式: 。
(5)写出E在铜催化下与O2反应生成物的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构)其中核磁共振氢谱为5组峰的为 (写结构简式)。
CO2和CH4是两种重要的温室气体.通过CH4和CO2反应可以制造价值更高的化学品。
(1)25℃时.以镍合金为催化剂,向4L容器中通人6 mol CO2,4mol CH4,发生反应:
CO2(g)+CH4(g)  2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为____________.
②已知①CH4(g)+2O2(g)=CO2(g)+2H2O (g) ΔH= -890.3KJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= +2.8KJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH= -566.0KJ/mol
求反应CO2(g)+ CH4(g) 2CO(g) +2H2(g)的ΔH=___________KJ/mol
2CO(g) +2H2(g)的ΔH=___________KJ/mol
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4(g) CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题:
CH3COOH温度与催化剂的催化效率和乙酸的生成速率如图,请回答下列问题: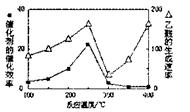
①250-3000C时,温度升高而乙酸的生成速率降低的原因是 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2条)。
(3)Li4SiO4可用于吸收、释放CO2,原理是,5000C时CO2与Li2SiO4接触生成Li2CO3;平衡后加热至7000C ,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件): 。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物.多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。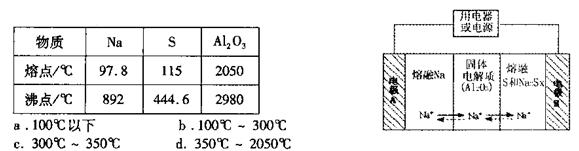
②放电时电极A为 极。
③充电时,总反应为Na2Sx="2Na+xS" (3<x<5).则阳极的电极反应式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号