一在密闭容器中进行反应CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是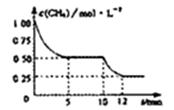
| A.0~5min内,v(H2)=0.1mol/L·min |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时.改变的外界条件可能是升高温度 |
一在密闭容器中进行反应CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
| A.0~5min内,v(H2)=0.1mol/L·min |
| B.反应进行到12min时,CH4的转化率为25% |
| C.恒温下,缩小容器体积,平衡后H2浓度减小 |
| D.10 min时.改变的外界条件可能是升高温度 |