天津市河东区高三一模考试化学试卷
化学与人类生产、生活密切相关,下列有关说法不正确的是
| A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
| B.福尔马林可浸制标本,利用了其使蛋白质变性的性质 |
| C.医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
| D.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
下列关于元素及其化合物的说法正确的是
| A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生剧烈的反应 |
| B.NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂 |
| C.通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体 |
| D.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
关于下列各实验装置的叙述中,不正确的是
| A.图①可用于实验室制备少量Cl2或NH3 |
| B.可用从a处加水的方法检验装置②的气密性 |
| C.实验室也可以用装置③收集HCl气体 |
| D.装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出 |
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
| A.其分子式为C15H18O4 |
| B.既能发生加聚反应,又能发生缩聚反应 |
| C.分子中含有2个手性碳原子 |
| D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
K1 |
K2 |
K3 |
K4 |
K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
| A.镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O |
| B.电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
| 甲 |
乙 |
|
| |
丙 |
丁 |
请用化学用语回答:
(1)丙在元素周期表中的位置是 。
(2)丁单质的电子式是 。
(3)乙的两种常见单质分别是 、 。
(4)甲、乙、丙、丁的气态氢化物水溶液显酸性的是 、___________。
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是____________ (填化学式)。此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
(6)电解丙的饱和钠盐溶液的离子方程式为 。
(7)若甲的元素符号为X。已知:①X2(g)+2O2(g)===X2O4(l) ΔH=-19.5 kJ·mol-1;
②X2H4(l)+O2(g)===X2(g)+2H2O(g)ΔH=-534.2 kJ·mol-1。
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化学方程式为 。
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
已知:
(1)A分子中的官能团名称是 、
(2)A的结构简式是
A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ;
其反应类型是 反应。
II.用烃C或苯合成PMLA的路线如下。
已知:
(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是
(5)E的结构简式是
(6)G与NaOH溶液在加热条件下反应的化学方程式是
(7)H的核磁共振氢谱呈现 个吸收峰。
(8)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)
________________________________________________________
(18分)Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为 。
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。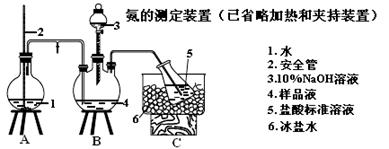
①盛放5(盐酸标准溶液)的仪器名称 。
②装置中安全管的作用原理是 。
③样品中氨的质量分数表达式为 。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: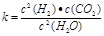 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A.=0.8mol·L-1 B.=1.4mol·L-1
C.<1.4mol·L-1 D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A.0.6mol1.0mol0.5mol1.0mol
B.0.6mol2.0mol0mol0mol
C.1.0mol2.0mol1.0mol2.0mol
D.0.25mol0.5mol0.75mol1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)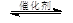 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号