在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是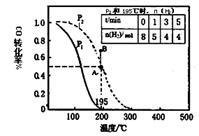
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)  2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )

| |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
| X |
1 |
0.80 |
0.66 |
0.58 |
0.52 |
0.50 |
0.50 |
| Y |
2 |
1.80 |
1.66 |
… |
… |
… |
… |
A.前5min用Z表示的平均反应速率为0.2mol/(L·min)
B.该反应的正反应是放热反应,且T1>T
C.在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变
D.若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7%
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
| A.生成乙烯的速率:v(M)有可能小于v(N) |
| B.平衡常数:KM>KN |
| C.当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 |
| D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g)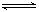 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
| t/min |
2 |
4 |
6 |
8 |
10 |
| n(A)/mol |
0.16 |
0.13 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率ν(C) ="0.02" mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
A.该反应的热化学方程式为:X(g)+3Y(g) 2Z(g);△H<0 2Z(g);△H<0 |
| B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率增大 |
| C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
| 编号 |
温度(℃) |
起始物质的量 (mol) |
平衡物质的量 (mol) |
达到平衡所需时间(s) |
|
| PCl5(g) |
PCl3(g) |
Cl2(g) |
|||
| Ⅰ |
320 |
0.40 |
0.10 |
0.10 |
t1 |
| Ⅱ |
320 |
0.80 |
|
|
t2 |
| Ⅲ |
410 |
0.40 |
0.15 |
0.15 |
t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L•s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是
A.该反应的逆反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.达到平衡时,容器Ⅰ中的压强与容器Ⅲ中的压强相同
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行
在体积为2L的密闭容器中进行下列反应:C(g)+CO2(g) 2CO(g);△H=Q kJ·mol-1。下图为CO2、CO的物质的量随时间t的变化关系图。下列说法不正确的是( )
2CO(g);△H=Q kJ·mol-1。下图为CO2、CO的物质的量随时间t的变化关系图。下列说法不正确的是( )
| A.CO在2-3min和4-5min时平均速率相等 |
| B.当固焦炭的质量不发生变化时,说明反应已达平衡状态 |
| C.5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 |
| D.3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:
2SO2(g)+O2(g)⇌2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s |
0 |
t1 |
t2 |
t3 |
t4 |
| n(SO3)/mol |
0 |
0.8 |
1.4 |
1.8 |
1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)=0.4/t1mol•L-1•s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3,则此时V正>V逆
D.相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率大于10%
在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b>n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 |
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)  。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)  2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是( )
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |