(4分)现有可逆反应:mA(g)+nB(g) pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答:

(1)左图中温度t1℃ t2℃(填“高于”或“低于”)
(2)该反应的正反应为 反应(填“吸热”或“放热”)
(3)右图中压强 p1 p2(填“>”、“<”、“=”)
(4)反应式中(m +n) (p +q)(填“>”、“<”、“=”)
(本题16分) 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有______(选填字母)
| |
A |
B |
C |
D |
| n(CO2)/mol |
3 |
1 |
0 |
1 |
| n(H2)/mol |
2 |
1 |
0 |
1 |
| n(CO)/mol |
1 |
2 |
3 |
0.5 |
| n(H2O)/mol |
5 |
2 |
3 |
2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是__________。
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是____.
,下列有关该体系的说法正确的是____.
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时 增大 增大 |
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁能源,其燃烧产物为。
(2)是一种重要的储氢载体,能与水反应达到
,且反应前后
的化合价不变,该反应的化学方程式为,反应消耗1
时转移的电子数目为。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为,平衡时苯的浓度为
,该反应的平衡常数
=。
(4)一定条件下,题11图示装置可实现有机物的电化学储氢(忽略其它有机物)。

①导线中电子移动方向为。
②生成目标产物的电极反应式为
③该储氢装置的电流效率 =(
=( =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
合成氨是人类科学技术上的一项重大突破,其反应原理为:

一种工业合成氨的简易流程图如下:

(1)天然气中的杂质常用常用氨水吸收,产物为
。一定条件下向
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)步骤II中制氯气原理如下:
①
②
对于反应①,一定可以提高平衡体系中百分含量,又能加快反应速率的是。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将进一步转化,可提高
产量。若1
和
的混合气体(
的体积分数为20%)与
反应,得到1.18mol
、
和
的混合气体,则
转化率为。
(3)下左图表示500、60.0
条件下,原料气投料比与平衡时
体积分数的关系。根据图中
点数据计算
的平衡体积分数:。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),简述本流程中提高合成氨原料总转化率的方法:。
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的和
等气体。铜液吸收
的反应是放热反应,其反应方程式为:
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
(3)简述铜液吸收及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为。其中氮元素原子最外层电子排布的轨道表达式是。通过比较可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知与
分子结构相似,
的电子式是。
熔点高于
,其原因是。
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则该反应吸收或放出热量为 kJ(用含a b c d字母的代数式表示)
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?②4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)
(7分)(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为________________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
(15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)  Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1
C(s)+ O2(g)==CO2(g)  H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1
S(s)+O2(g)==SO2(g)  H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= kJ·mol-1。
H= kJ·mol-1。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)="0.003" mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质: ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1
请写出 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
① N2(g)+O2(g)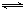 2NO(g)△H= 。
2NO(g)△H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。

(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH-、H+四种微粒浓度由大到小关系为: 。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 ,得到如下两组数据:
,得到如下两组数据:
①实验2条件下平衡常数K= __________。
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时 ____________
____________ (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。
③由两组实验结果,可判断该反应的正反应△H_____________0(填“<”,‘‘>”,“=”)。
(3)己知在常温常压下:
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________
①已知该反应的△H>0,简述该设想能否实现的依据:________。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8× 10 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的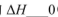 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图。
(2) 25℃时,某同学将0.lmol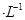 盐酸与0.2 mol
盐酸与0.2 mol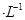 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数 )
)
(3) 25℃时,向O.lmol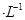 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol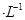 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol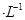 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时, ,
, )
)