广东省珠海市高三学业质量监测二模理综化学试卷
下列与有机物的结构、性质有关的叙述正确的是
| A.苯、油脂均不能使酸性KMnO4溶液褪色 |
| B.聚酯纤维、有机玻璃、光导纤维都属于有机高分子材料 |
| C.乙醇可以被氧化为乙酸,二者都能发生取代反应 |
| D.淀粉和蛋白质均可作为生产葡萄糖的原料 |
下列有关物质的性质或应用正确的是
| A.单质硅用于制造芯片和光导纤维 |
| B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D.30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
设NA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:N-14 O-16)
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B.标准状况下,2.24 L乙醇中含有的C—H数目为0.5NA |
| C.1 mol·L-1的NaClO溶液中所含ClO-的数目为NA |
| D.室温下H2O2分解得到16 g O2,转移的电子数为2NA |
下列叙述中正确的是
| A.二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| B.碳酸钠溶液呈碱性,医疗上常用碳酸钠治疗胃酸过多 |
| C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
| A.工业上电解YW饱和溶液冶炼金属Y |
| B.气态氢化物的稳定性:W > X |
| C.简单离子半径的大小顺序:r(Y+)>r(X—) |
| D.Y、W的最高价氧化物的水化物均能溶解金属Z |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+) > c(Cl-) > c(OH-) > c(H+) |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向某溶液中加入盐酸酸化的BaCl2溶液 |
生成白色沉淀 |
该溶液中一定含有SO42— |
| B |
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 |
实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 |
氧化性:Br2>Fe3+>I2 |
| C |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
| D |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
Heck反应是偶联反应的一种,例如:
反应①:
化合物Ⅰ可以由以下途径合成: 
(1)化合物Ⅱ的分子式为 ,1mol该物质最多可与 molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程
为 (注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为 。
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚,则其加聚产物的结构简式为 。
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为 。
(6)一定条件下, 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为 。
也可以发生类似反应①的反应,其有机产物的结构简式为 。
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: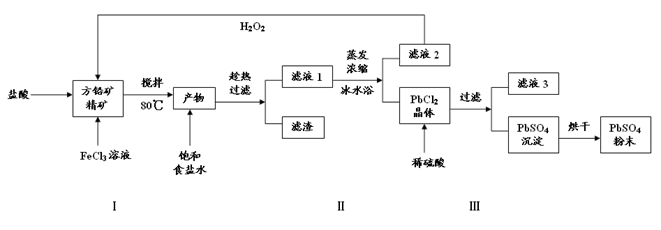
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
(1)下图为实验室制备、收集少量HCl的装置。
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。
① 按上图所示的装置图连接好各仪器。
② 检验装置的气密性。
③ 在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。
装置C的作用是 。
④ 反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤ 把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。
其中试剂为 ,操作名称为 。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号